题目内容
15.科学的假设与猜想是科学探究的先导和价值所在.在下列假设或猜想引导下的探究肯定没有意义的是( )| A. | 探究SO2和Na2O2可能化合生成Na2SO4 | |
| B. | 探究NO和N2O可能化合生成NO2 | |
| C. | 探究铜在灼烧时出现的黑色物质可能是炭黑 | |
| D. | 探究红色酚酞试液通入Cl2褪色,原因是溶液酸碱性改变或被漂白 |
分析 A.二氧化硫具有较强还原性,容易被氧化,过氧化钠具有强氧化性,反应产物中可能会含有硫酸钠;
B.NO中氮元素化合价为+2价,N2O化合价是+1价,化合生成NO2时化合价都升高,不符合氧化还原反应的本质特征;
C.酒精灯中的酒精不完全燃烧可能会生成炭黑;
D.氯气和碱反应,减小了溶液中的氢氧根离子浓度,氯气与水反应生成次氯酸具有漂白性,能够使酚酞褪色.
解答 解:A.二氧化硫具有还原性,过氧化钠具有氧化性,SO2和Na2O2反应可能有Na2SO4生成,该探究具有实际意义,故A不选;
B.NO中N元素化合价是+2价,N2O中N元素的化合价为+1价,二氧化氮中N元素的化合价为+4价,发生氧化还原反应生成NO2时化合价都升高,不符合氧化还原反应的本质特征,不必探究即可否决该猜想,所以该探究没有意义,故B选;
C.铜在灼烧时,酒精灯中的酒精不完全燃烧可能会生成炭黑,所以铜在灼烧时出现的黑色物质可能是炭黑,有探究的意义,故C不选;
D.氯气和氢氧化钠反应生成氯化钠、次氯酸钠和水,消耗氢氧化钠溶液,滴有酚酞的红色溶液褪色,而氯气可以与水反应生成的次氯酸,次氯酸具有强氧化性,能够使有色物质褪色,所以该探究有意义,故D不选;
故选B.
点评 本题考查了物质性质实验方案的设计,题目难度中等,注意掌握常见物质组成及化学性质,可以依据质量守恒定律、氧化还原反应规律、物质间的反应规律等知识进行判断,试题侧重考查学生的分析、理解能力.

练习册系列答案
相关题目
5.对于化学反应方向的确定,下列说法正确的是( )
| A. | 固体的溶解过程与焓变有关 | |
| B. | 温度、压强一定时,放热的熵增加反应不一定能自发进行 | |
| C. | 反应焓变是决定反应能否自发进行的唯一因素 | |
| D. | 在温度、压强一定的条件下,焓因素和熵因素共同决定一个化学反应的方向 |
6.如图是以石油为原料的部分转化流程,则下列说法正确的是( )
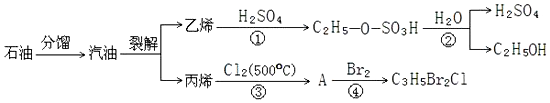

| A. | 石油分馏和裂解均属于化学变化 | |
| B. | 反应①②表明硫酸可用于乙烯水化法制乙醇的催化剂 | |
| C. | 反应①与反应④均属于加成反应 | |
| D. | 反应③的原子利用率为100% |
3.药物贝诺酯可由乙酰水杨酸和对乙酰氨基酚在一定条件下反应制得:
 ,说法正确的是( )
,说法正确的是( )
 ,说法正确的是( )
,说法正确的是( )| A. | 贝诺酯分子中有三种含氧官能团 | |
| B. | 可用FeCl3溶液区别乙酰水杨酸和对乙酰氨基酚 | |
| C. | 乙酰水杨酸和对乙酰氨基酚均能与NaHCO3溶液反应 | |
| D. | 贝诺酯与足量NaOH溶液共热,最终生成乙酰水杨酸钠和对乙酰氨基酚钠 |
10.250℃时,向一2L的恒容密闭容器内充入1molCO和2molH2,发生反应:CO(g)+2H2(g)?CH3OH(g)△H<0,测得容器内压强的变化如表:
下列说法错误的是( )
| 反应时间/min | 0 | 5 | 10 | 15 | 20 | 25 |
| 压强/MPa | 12.6 | 10.8 | 9.5 | 8.7 | 8.4 | 8.4 |
| A. | 当容器中气体的压强保持不变时,说明该反应已达平衡 | |
| B. | 0~20min内,以CO表示的平均反应速率为0.0125mol•L-1•min-1 | |
| C. | 该温度下平衡常数K的数值为16 | |
| D. | 升高温度,K值减小 |
20.25℃和101kpa时,乙烷、乙炔和丙烯组成的混合烃20mL与过量氧气混合并完全燃烧,除去水蒸气,恢复到原来的温度和压强,气体的总体积缩小了42mL,原混合烃中乙炔的体积分数为( )
| A. | 25% | B. | 40% | C. | 60% | D. | 75% |
7.已知反应①:CO(g)+CuO(s)?CO2(g)+Cu(s)和反应②:H2(g)+CuO(s)?Cu(s)+H2O(g)在相同温度下的平衡常数分别为K1和K2,该温度下反应③:CO(g)+H2O(g)?CO2(g)+H2(g)的平衡常数为K.则下列说法正确的是( )
| A. | 反应①的平衡常数K1=$\frac{c(C{O}_{2})•c(Cu)}{c(CO)•c(CuO)}$ | |
| B. | 反应③的平衡常数K=$\frac{{K}_{1}}{{K}_{2}}$ | |
| C. | 对于反应③,恒容时,若温度升高,H2的浓度减小,则该反应的焓变为正值 | |
| D. | 对于反应②,恒温恒容时,若加入CuO,平衡向正向移动,H2的浓度减小 |
4.一定温度下,在三个体积均为2.0L的恒容密闭容器中发生反应:PCl5(g)?PCl3(g)+Cl2(g),相关信息如表所示:
下列说法正确的是( )
| 编号 | 温度(℃) | 起始物质的量 (mol) | 平衡物质的量 (mol) | 达到平衡所需时间 (s) | |
| PCl5(g) | PCl3(g) | Cl2(g) | |||
| Ⅰ | 320 | 0.40 | 0.10 | 0.10 | 2 |
| Ⅱ | 320 | 0.80 | t1 | ||
| Ⅲ | 410 | 0.40 | 0.15 | 0.15 | t2 |
| A. | 平衡常数K:容器Ⅱ>容器Ⅲ | |
| B. | 反应到达平衡时,容器Ⅱ中PCl5的转化率小于25% | |
| C. | 反应到达平衡时,容器I中的平均速率为v(PCl5)=0.05mol•L-1•s-1 | |
| D. | 起始时向容器Ⅲ中充入0.30molPCl5、0.45molPCl3和0.10molCl2,则反应将向逆反应方向进行 |
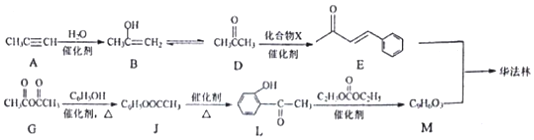
 .
.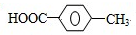 ,R→S的化学方程式为
,R→S的化学方程式为 .
.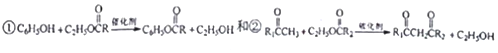
 .
.