题目内容
10.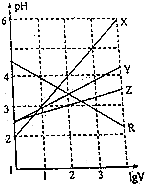 取0.1mol•L-1的NaA和NaB两种盐溶液各1L,分别通入0.02mol CO2,发生如下反应:NaA+CO2+H2O?HA+NaHCO3、2NaB+CO2+H2O?2HB+Na2CO3.则HA和HB的1L溶液分别加水稀释至体积为VL时对应的曲线是( )
取0.1mol•L-1的NaA和NaB两种盐溶液各1L,分别通入0.02mol CO2,发生如下反应:NaA+CO2+H2O?HA+NaHCO3、2NaB+CO2+H2O?2HB+Na2CO3.则HA和HB的1L溶液分别加水稀释至体积为VL时对应的曲线是( )| A. | X是HA、Z是HB | B. | Y是HA、Z是HB | C. | Z是HA、R是HB | D. | Z是HA、Y是HB |
分析 已知:NaA+CO2+H2O?HA+NaHCO3、2NaB+CO2+H2O?2HB+Na2CO3,则酸性:H2CO3>HA>HCO3->HB,加水稀释,促进弱酸的电离,酸性越弱,溶液稀释时pH变化越小,据此分析.
解答 解:已知:NaA+CO2+H2O?HA+NaHCO3、2NaB+CO2+H2O?2HB+Na2CO3,则酸性:H2CO3>HA>HCO3->HB,加水稀释,促进弱酸的电离,酸性越弱,溶液稀释时pH变化越小,所以加水稀释相同的倍数时,pH变化小的是HB,由图可知,Z为HB,Y为HA,故B正确;
故选B.
点评 本题考查了弱电解质的电离,题目难度不大,注意把握弱电解质的电离特点以及加水稀释时弱酸的pH变化.

练习册系列答案
 ABC考王全优卷系列答案
ABC考王全优卷系列答案
相关题目
20.一定条件下,可逆反应的平衡常数可以用平衡浓度计算.也可以用平衡分压代替平衡浓度计算,分压=总压×物质的量分数.在恒温恒压条件下,总压不变,用平衡分压计算平衡常数更方便.下列说法不正确的是( )
| A. | 对于C2H4(g)+H2O(g)═C2H5OH(g)在一定条件下达到平衡状态时,体系的总压强为P,其中C2H4(g)、H2O(g)、C2H5OH(g)均为l mol,则用分压表示的平衡常数Kp=$\frac{3}{P}$ | |
| B. | 恒温恒压下,在一容积可变的容器中,反应2A(g)+B(g)═2C(g)达到平衡时,A、B和C的物质的量分别为4 mol、2 mol和4 mol.若此时A、B和C均增加1 mol,平衡正向移动 | |
| C. | 一恒温恒压下,在一容积可变的容器中,N2(g)+3H2(g)═2NH3(g)达到平衡状态时,N2、H2、NH3各l mol,若此时再充入3mol N2,则平衡正向移动 | |
| D. | 对于一定条件下的某一可逆反应,用平衡浓度表示的平衡常数和用平衡分压表示的平衡常数,其数值不同,但意义相同,都只与温度有关 |
1.元素X的原子核外M电子层上有3个电子,元素Y2-的离子核外有18个电子,则这两种元素可形成的化合物为( )
| A. | XY2 | B. | X2Y3 | C. | X3Y2 | D. | XY |
18.标准状况下,乙烷与炔烃X组成的混合烃22.4L与过量的氧气混合并完全燃烧,通过浓硫酸后,恢复到原来的温度,气体的总体积缩小了44.8L,则炔烃X是( )
| A. | C2H2 | B. | C3H4 | C. | C4H6 | D. | C5H8 |
5.有a、b、c、d四种元素,原子序数依次增大.a存在a+和a-两种离子,b和c为同一主族元素,c的次外层有8个电子,c2-和d2+的电子层结构相同.下列叙述正确的是( )
| A. | b、c与a形成化合物的稳定性一定为b>c | |
| B. | a和d形成的化合物与水反应产生气体可以作燃料 | |
| C. | c,a和b可形成的化合物为离子化合物 | |
| D. | a、b、c、d四种元素组成的化合物的水溶液可以为酸性、也可以为碱性 |
15.在如图装置中,铁片上没有气泡产生的是( )


| A. | A | B. | B | C. | C | D. | D |
2.下列体系加压后,对化学反应速率没有影响的是( )
| A. | 2SO2+O2?2SO3 | B. | CO+H20(气)?CO2+H2 | ||
| C. | CO2+H2O?H2CO3 | D. | NaOH+HCl=NaCl+H20 |
15.下列化学用语表达正确的是( )
| A. | 溴化铵的电子式: | B. | CO2的电子式: | ||
| C. | HClO的结构式:H-Cl-O | D. | 氮分子的结构式:N≡N |
16.实验中的下列操作正确的是( )
| A. | 用试管取出试剂瓶中的Na2CO3溶液,发现取量过多,为了不浪费,又把过量的试剂倒入试剂瓶中 | |
| B. | Ba(NO3)2 溶于水,可将含有Ba(NO3)2 的废液倒入水槽中,再用水冲入下水道 | |
| C. | 用蒸发方法使NaCl 从溶液中析出时,应将蒸发皿中NaCl 溶液全部加热蒸干 | |
| D. | 用滴管滴加液体时,滴管应垂悬在容器上方,不能触及容器内壁 |