题目内容
15.在如图装置中,铁片上没有气泡产生的是( )
| A. | A | B. | B | C. | C | D. | D |
分析 该装置中,活泼的一极作负极,发生氧化反应,相对不活泼的一极作正极,得电子发生还原反应,铁片没有气泡,说明铁不能作正极,据此分析.
解答 解:活泼的一极作负极,发生氧化反应,相对不活泼的一极作正极,得电子发生还原反应,铁片没有气泡,说明铁不能作正极,
A.锌易失电子作负极,铁作正极,氢离子在铁上得电子生成氢气,故A错误;
B.铁作负极,故B正确;
C.铁直接与硫酸反应产生氢气,故C错误;
D.铁作正极,正极上氢离子得电子生成氢气,故D错误.
故选:B.
点评 本题考查了原电池原理,明确正负极的判断方法、正负极发生的反应即可解答,题目难度不大.

练习册系列答案
相关题目
5.下列离子或分子组中,在相应的环境中一定能大量共存的是( )
| 选项 | 环境要求 | 离子 |
| A | 溶液中c(K+)<c(Cl-) | K+、AlO2-、Cl-、NO3- |
| B | NaHCO3溶液 | K+、ClO-、AlO2- |
| C | 水电离产生的c(H+)=10-12 mol/L-1的溶液 | ClO-、CO32-、NH4+、NO3-、SO32- |
| D | 逐滴滴加氨水立即有沉淀产生 | Na+、HCO3-、Mg2+、SO42- |
| A. | A | B. | B | C. | C | D. | D |
6.Li-Al/FeS电池是一种正在开发的车载锂电池,该电池中正极的电极反应式为:2Li++FeS+2e-═Li2S+Fe有关该电池的下列说法中,正确的是( )
| A. | 该电池的电池反应式为:2Li+FeS═Li2S+Fe | |
| B. | Li-Al在电池中作为负极材料,该材料中Li的化合价为+1价 | |
| C. | 负极的电极反应式为Al-3e-═Al3+ | |
| D. | 电解质溶液可以是氢氧化钠溶液或者稀硫酸 |
3.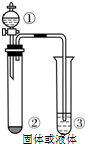 仅用下表右边的装置和表中提供的相应容器中的物质完成相关实验,最合理的选项是( )
仅用下表右边的装置和表中提供的相应容器中的物质完成相关实验,最合理的选项是( )
 仅用下表右边的装置和表中提供的相应容器中的物质完成相关实验,最合理的选项是( )
仅用下表右边的装置和表中提供的相应容器中的物质完成相关实验,最合理的选项是( )| 选项 | ① | ② | ③ | 实验目的或结论 |
| A | 浓氨水 | 生石灰 | 水 | 制取氨气并吸收尾气 |
| B | 浓盐酸 | 二氧化锰 | 淀粉碘化钾溶液 | 氧化性:MnO2>Cl2>I2 |
| C | 浓磷酸 | 氢溴酸溶液 | AgCl的浊液 | 验证Ksp(AgCl)>Ksp(AgBr) |
| D | 浓硫酸 | 亚硫酸钠 | 高锰酸钾溶液 | 验证二氧化硫的漂白性 |
| A. | A | B. | B | C. | C | D. | D |
10. 取0.1mol•L-1的NaA和NaB两种盐溶液各1L,分别通入0.02mol CO2,发生如下反应:NaA+CO2+H2O?HA+NaHCO3、2NaB+CO2+H2O?2HB+Na2CO3.则HA和HB的1L溶液分别加水稀释至体积为VL时对应的曲线是( )
取0.1mol•L-1的NaA和NaB两种盐溶液各1L,分别通入0.02mol CO2,发生如下反应:NaA+CO2+H2O?HA+NaHCO3、2NaB+CO2+H2O?2HB+Na2CO3.则HA和HB的1L溶液分别加水稀释至体积为VL时对应的曲线是( )
 取0.1mol•L-1的NaA和NaB两种盐溶液各1L,分别通入0.02mol CO2,发生如下反应:NaA+CO2+H2O?HA+NaHCO3、2NaB+CO2+H2O?2HB+Na2CO3.则HA和HB的1L溶液分别加水稀释至体积为VL时对应的曲线是( )
取0.1mol•L-1的NaA和NaB两种盐溶液各1L,分别通入0.02mol CO2,发生如下反应:NaA+CO2+H2O?HA+NaHCO3、2NaB+CO2+H2O?2HB+Na2CO3.则HA和HB的1L溶液分别加水稀释至体积为VL时对应的曲线是( )| A. | X是HA、Z是HB | B. | Y是HA、Z是HB | C. | Z是HA、R是HB | D. | Z是HA、Y是HB |
20.下列有关化学用语的表示或说法正确的是( )
| A. | H3O+的电子式为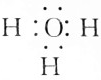 | |
| B. | -NH2的电子式为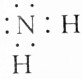 | |
| C. | NaHS显碱性的原因是HS-+H2O?S2-+H3O+ | |
| D. | 乙烷的二氯代物有两种(不考虑立体异构) |
3.粗盐提纯制精盐的实验中,不需要的操作是( )
| A. | 溶解 | B. | 过滤 | C. | 洗涤 | D. | 蒸馏 |
1.下列有关说法正确的是( )
| A. | 漂白粉、氨水和液氯都属于混合物 | |
| B. | 稀硝酸可除去试管内壁的银镜 | |
| C. | Fe(OH)3胶体无色、透明,能产生丁达尔现象 | |
| D. | SiO2既能和NaOH溶液反应又能和氢氟酸反应,所以是两性氧化物 |
 ;
;