题目内容
15.下列化学用语表达正确的是( )| A. | 溴化铵的电子式: | B. | CO2的电子式: | ||
| C. | HClO的结构式:H-Cl-O | D. | 氮分子的结构式:N≡N |
分析 A.溴化铵的电子式中,铵根离子中氮原子和氢原子的最外层电子数应该标出;
B.CO2是共价化合物,其结构式为O=C=O,据此书写电子式;
C.次氯酸的中心原子是氧原子,结构式为H-O-Cl;
D.用短线“-”代替共用电子对即为结构式,结构式只把共用电子对用短线表示,未成键的电子不画出.
解答 解:A.溴化铵为离子化合物,阳离子为原子团,电子式中需要标出N、H原子的最外层电子数,溴化铵的电子式为: ,故A错误;
,故A错误;
B.CO2是共价化合物,其结构式为O=C=O,碳原子和氧原子之间有2对电子,其电子式为 ,故B错误;
,故B错误;
C.次氯酸的中心原子是氧原子,结构式为H-O-Cl,故C错误;
D.N原子之间形成三对共用电子对,结构式只把共用电子对用短线表示,未成键的电子不画出,N2的结构式为N≡N,故D正确,故选D.
点评 本题考查了化学用语,难度不大,知道常见化学用语的应用,注意次氯酸的中心原子是哪种元素,为易错点.

练习册系列答案
 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案
相关题目
9.短周期元素W、X、Y、Z的原子序数依次增大,W的一种核素在考古时常用来鉴定一些文物的年代,X原子核外M电子层的电子数为1,Y是地壳中含量最高的金属元素,Z的单质可用于自来水的杀菌消毒.根据以上叙述,下列说法中正确的是( )
| A. | 四种元素的原子半径大小为Z>Y>X>W | |
| B. | 元素W与氢形成的原子比为1:1的化合物只有2种 | |
| C. | X、Y、Z的最高价氧化物对应的水化物能相互反应 | |
| D. | 由Y与Z组成的化合物在熔融时能导电 |
10. 取0.1mol•L-1的NaA和NaB两种盐溶液各1L,分别通入0.02mol CO2,发生如下反应:NaA+CO2+H2O?HA+NaHCO3、2NaB+CO2+H2O?2HB+Na2CO3.则HA和HB的1L溶液分别加水稀释至体积为VL时对应的曲线是( )
取0.1mol•L-1的NaA和NaB两种盐溶液各1L,分别通入0.02mol CO2,发生如下反应:NaA+CO2+H2O?HA+NaHCO3、2NaB+CO2+H2O?2HB+Na2CO3.则HA和HB的1L溶液分别加水稀释至体积为VL时对应的曲线是( )
 取0.1mol•L-1的NaA和NaB两种盐溶液各1L,分别通入0.02mol CO2,发生如下反应:NaA+CO2+H2O?HA+NaHCO3、2NaB+CO2+H2O?2HB+Na2CO3.则HA和HB的1L溶液分别加水稀释至体积为VL时对应的曲线是( )
取0.1mol•L-1的NaA和NaB两种盐溶液各1L,分别通入0.02mol CO2,发生如下反应:NaA+CO2+H2O?HA+NaHCO3、2NaB+CO2+H2O?2HB+Na2CO3.则HA和HB的1L溶液分别加水稀释至体积为VL时对应的曲线是( )| A. | X是HA、Z是HB | B. | Y是HA、Z是HB | C. | Z是HA、R是HB | D. | Z是HA、Y是HB |
3.粗盐提纯制精盐的实验中,不需要的操作是( )
| A. | 溶解 | B. | 过滤 | C. | 洗涤 | D. | 蒸馏 |
10.既有离子键又有共价键和配位键的化合物是( )
| A. | HN03 | B. | Ba(OH)2 | C. | (NH4)2SO4 | D. | H2O |
7.用NA表示阿伏伽德罗常数的值.下列判断正确的是( )
| A. | 1g H2含有的氢原子数目为NA | |
| B. | 常温常压下,22.4L O2含有的分子数目为NA | |
| C. | 1L1mol•L-1KOH溶液中含有的钾离子数目为NA | |
| D. | 1molZn变为Zn2+失去的电子数目为NA |
4.温度相同、浓度均为0.2mol/L的①(NH4)2SO4、②NaNO3、③NH4HSO4、④NH4NO3、⑤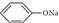 ⑥CH3COONa溶液,它们的pH值由小到大的排列顺序是( )
⑥CH3COONa溶液,它们的pH值由小到大的排列顺序是( )
 ⑥CH3COONa溶液,它们的pH值由小到大的排列顺序是( )
⑥CH3COONa溶液,它们的pH值由小到大的排列顺序是( )| A. | ③①④②⑥⑤ | B. | ①③⑥④②⑤ | C. | ③②①⑥④⑤ | D. | ⑤⑥②④①③ |
 ;
;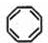 互为同分异构体且属于芳香烃的分子的结构简式:
互为同分异构体且属于芳香烃的分子的结构简式: ;
;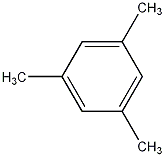 、
、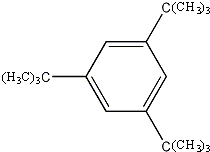 .
.