题目内容
4.工业上将纯净干燥的氯气通入到物质的量浓度为0.375mol/L的NaOH溶液中得到漂水.某同学在实验室利用下述实验装置探究Cl2性质并模拟制备漂水.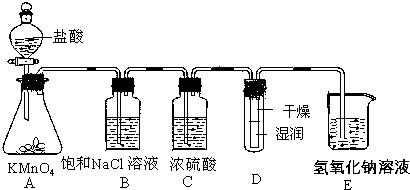
(1)配制470mL物质的量浓度为0.375mol/L的NaOH溶液时,主要用到的玻璃仪器有烧杯、玻璃棒、胶头滴管、量筒和500mL容量瓶.
(2)浓硫酸的作用是干燥氯气.
(3)装置E中发生反应的离子方程式为Cl2+2OH-=Cl-+ClO-+H2O.
(4)装置B中饱和NaCl溶液可用于除去Cl2中的HCl气体,已知氯气与水的反应是一个可逆反应,请简述用饱和NaCl溶液除去Cl2中HCl气体的原理(用离子方程式表示,并配必要的文字说明)HCl溶于水电离出的H+和饱和NaCl溶液中的Cl- 都会对反应Cl2+H2O?H++Cl-+HClO 起到抑制作用
、.
(5)实验时装置D中湿润的红色纸条褪色,干燥部分没有褪色,放置一段时间后,纸条全部褪色.该同学认为Cl2的密度比空气大,可能是试管下部Cl2的浓度大于试管上部Cl2的浓度所导致的.请判断该解释是否合理,并分析产生上述实验现象的原因不合理;实验进行中Cl2与湿润红色纸条中的水反应生成HClO使湿润的红色纸条褪色,干燥部分没有HClO,所以纸条不褪色;放置一段时间,由于烧杯中的水蒸气过来或纸条下端的水分子运动导致纸条上端湿润而褪色.
(6)如果制得氯元素含量为10%的漂水溶液35.5g,那么其中含NaClO的物质的量为0.05mol.
分析 探究Cl2性质并模拟制备漂水流程:A装置:浓盐酸与高锰酸钾反应生成氯气2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O,当含氯化氢的氯气通过饱和食盐水时,氯化氢溶解在其中,氯气几乎不溶,B装置:用饱和食盐水,除去氯气中的氯化氢杂质;浓硫酸具有吸水性,且不与氯气反应,装置C:浓硫酸的作用为干燥氯气,装置D:干燥氯气不能使有色布条褪色,干燥的红色布条看不到明显现象,湿润的红色纸条褪色,是因为氯气和水反应生成具有漂白性的HClO,氯气都有毒,会污染空气,装置E:吸收尾气.
(1)根据溶液配制中用到的仪器来分析,配制470mL溶液,应选择500mL容量瓶;
(2)浓硫酸具有吸水性,可用来干燥气体;
(3)氯气有毒,不能排放在环境中,用NaOH溶液吸收;
(4)根据离子的浓度来分析平衡移动;
(5)根据氯气不能使红色物质褪色,HClO使有色的物质褪色及水分子的运动来分析;
(6)氯元素含量为10%的漂水溶液35.5g,则m(Cl)=3.55g,n(Cl)=0.1mol,再利用n(Cl)=n(NaCl)+n(NaClO)及Cl2+2NaOH═NaCl+NaClO+H2O来分析.
解答 解:(1)配制一定物质的量浓度的溶液使用的玻璃仪器有烧杯、玻璃棒、胶头滴管、量筒和容量瓶,配制470mL溶液,应选择500mL容量瓶,
故答案为:500mL容量瓶;
(2)因浓硫酸具有吸水性,且不与氯气反应,则装置C中浓硫酸的作用为干燥氯气,
故答案为:干燥氯气;
(3)未参加反应的氯气不能排放在环境中,则装置E为吸收尾气的装置,其离子反应为Cl2+2OH-=Cl-+ClO-+H2O,
故答案为:Cl2+2OH-=Cl-+ClO-+H2O;
(4)氯气溶于水发生Cl2+H2O?H++Cl-+HClO,而HCl溶于水电离出的H+和饱和NaCl溶液中的Cl-都会对反应Cl2+H2O?H++Cl-+HClO起到抑制作用,则可利用饱和NaCl溶液除去Cl2中HCl气体,
故答案为:HCl溶于水电离出的H+和饱和NaCl溶液中的Cl-都会对反应Cl2+H2O?H++Cl-+HClO起到抑制作用;
(5)因氯气不能使红色物质褪色,HClO使有色的物质褪色,且一段时间后水分子能运动到干燥的红色纸条中,则实验不合理,可设计实验室将湿润的红色纸条与干燥的纸条分离,如设计为取一塑料板将干燥的红色纸条和湿润的红色纸条分别贴在塑料板两侧,将该装置放入装置D中或将氯气先通入装有干燥的红色纸条的试管,再通入装有湿润的红色纸条的试管中,
故答案为:不合理;实验进行中Cl2与湿润红色纸条中的水反应生成HClO使湿润的红色纸条褪色,干燥部分没有HClO,所以纸条不褪色;放置一段时间,由于烧杯中的水蒸气过来或纸条下端的水分子运动导致纸条上端湿润而褪色;
(6)氯元素含量为10%的漂水溶液35.5g,则m(Cl)=×10%=3.55g,n(Cl)=$\frac{3.55g}{35.5g/mol}$=0.1mol,由Cl2+2NaOH═NaCl+NaClO+H2O可知,n(Cl)=n(NaCl)+n(NaClO),则n(NaClO)=$\frac{0.1mol}{2}$=0.05mol,
故答案为:0.05..
点评 本题考查氯气的制取实验装置及氯气的性质,明确装置的作用及装置中发生的化学反应即可解答,题目难度中等,利用反应来分析问题是学生在解答中易忽视的地方,注意计算中量的关系为解答的易错点.

| A. |  | B. |  | ||
| C. |  | D. |  |
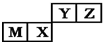
| A. | 原子半径:M>X>Y>Z | |
| B. | M的氯化物是弱电解质 | |
| C. | X的最简单气态氢化物的热稳定性比Z的小 | |
| D. | 简单离子的半径M小于Z |
| 序号 | 电压/V | 阳极现象 | 检验阳极产物 |
| Ⅰ | x≥a | 电极附近出现黄色,有气泡产生 | 有Fe3+、有Cl2 |
| Ⅱ | a>x≥b | 电极附近出现黄色,无气泡产生 | 有Fe3+、无Cl2 |
| Ⅲ | b>x>0 | 无明显变化 | 无Fe3+、无Cl2 |
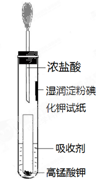
(2)Ⅰ中,Fe3+产生的原因可能是 Cl- 在阳极放电,生成的 Cl2将 Fe2+氧化.写出有关反应的方程式和电极反应式2Cl--2e-=Cl2↑、Cl2+2Fe2+=2Fe3++2Cl-.
(3)由Ⅱ推测,Fe3+产生的原因还可能是 Fe2+在阳极放电,电极反应式为
(4)Ⅱ中虽未检测出 Cl2,但 Cl- 在阳极是否放电仍需进一步验证.电解 pH=1 的 NaCl溶液做对照实验,记录如下:
| 序号 | 电压/V | 阳极现象 | 检验阳极产物 |
| Ⅳ | a>x≥c | 无明显变化 | 有Cl2 |
| Ⅴ | c>x≥b | 无明显变化 | 无Cl2 |
②与Ⅱ对比,可得出的结论:AC
A.通过控制电压,验证了 Fe2+先于 Cl- 放 电
B.电压过小,Cl- 可 能 不 放 电
C. 通过控制电压,证实了产生 Fe3+的两种原因都成立
D. 通过控制电压,证实了产生 Fe3+一定仅是由于生成的 Cl2将 Fe2+氧化.
| A. | Na Mg Al还原性依次减弱 | B. | I2 Br2 Cl2氧化性依次增强 | ||
| C. | C N O 原子半径依次增大 | D. | P S Cl 最高正价依次升高 |
 氯气是氯碱工业的主要产品之一,它是一种常用的消毒剂,其消毒原理是与水反应生成了次氯酸:
氯气是氯碱工业的主要产品之一,它是一种常用的消毒剂,其消毒原理是与水反应生成了次氯酸: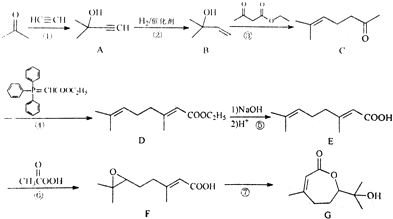
 .
. ,写出合成流程图(无机试剂任用).合成流程图示例如下:
,写出合成流程图(无机试剂任用).合成流程图示例如下: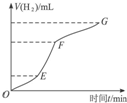 某化学课外小组的同学用Mg等与稀硫酸反应制H2,根据反应进行的情况,同学们得出了反应时间与产生H2的体积关系,并做出了如图.请回答:
某化学课外小组的同学用Mg等与稀硫酸反应制H2,根据反应进行的情况,同学们得出了反应时间与产生H2的体积关系,并做出了如图.请回答: