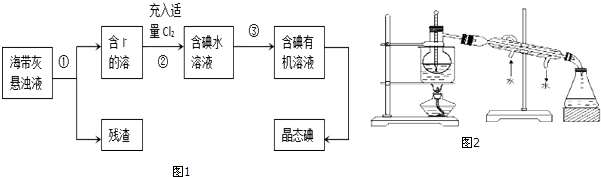
题目内容
12. 氯气是氯碱工业的主要产品之一,它是一种常用的消毒剂,其消毒原理是与水反应生成了次氯酸:
氯气是氯碱工业的主要产品之一,它是一种常用的消毒剂,其消毒原理是与水反应生成了次氯酸:Cl2+H2O?HCl+HClO K=4.5×10-4
次氯酸的强氧化性能杀死水中的病菌(不直接用次氯酸为自来水消毒是因为次氯酸易分解,且毒性较大).但是,由于氯气贮运不方便,且具有一定的危险性,目前正逐渐被其它性能优越的消毒产品所替代.请回答:
(1)氯碱工业生产氯气的化学方程式为2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$2NaOH+Cl2↑+H2↑.
(2)84消毒液(主要成分为NaClO)与氯气相比具有贮运方便等优点,用氯气与烧碱溶液反应制备84消毒液的离子方程式为Cl2+2OH-=Cl-+ClO-+H2O.
(3)二氧化氯是一种高效、广谱、安全的杀菌、保鲜剂.我国科学家研发了用氯气氧化亚氯酸钠(NaClO2)固体制备二氧化氯的方法,其化学方程式为Cl2+2NaClO2=2ClO2+2NaCl.
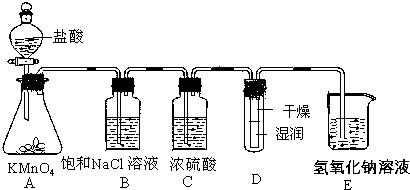
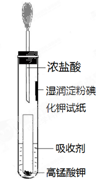
(4)一位同学设计了一套用浓盐酸和KMnO4固体制取少量氯气并比较氯气与碘单质的氧
化性强弱的微型装置(如图).
①下列溶液能吸收Cl2的是BC(填字母序号).
A.饱和食盐水 B.饱和Na2SO3溶液
C.饱和NaOH溶液 D.浓硫酸
②能说明Cl2的氧化性强于I2的实验现象是湿润淀粉碘化钾试纸变蓝.
分析 (1)氯碱工业生产氯气,电解饱和食盐水;
(2)用氯气与烧碱溶液反应制备84消毒液,生成NaCl、NaClO、水;
(3)用氯气氧化亚氯酸钠(NaClO2)固体制备二氧化氯,还生成NaCl;
(4)①碱性溶液及具有还原性的物质可吸收氯气;
②说明Cl2的氧化性强于I2的实验,利用氧化还原反应中氧化剂的氧化性大于氧化产物的氧化性说明.
解答 解:(1)氯碱工业生产氯气,电解饱和食盐水,反应为2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$2NaOH+Cl2↑+H2↑,故答案为:2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$2NaOH+Cl2↑+H2↑;
(2)用氯气与烧碱溶液反应制备84消毒液,生成NaCl、NaClO、水,离子反应为Cl2+2OH-=Cl-+ClO-+H2O,故答案为:Cl2+2OH-=Cl-+ClO-+H2O;
(3)用氯气氧化亚氯酸钠(NaClO2)固体制备二氧化氯,还生成NaCl,反应为Cl2+2NaClO2=2ClO2+2NaCl,故答案为:Cl2+2NaClO2=2ClO2+2NaCl;
(4)①C为碱性溶液,B具有还原性,则BC中的物质可吸收氯气,故答案为:BC;
②说明Cl2的氧化性强于I2的实验,氯气氧化KI生成碘,使淀粉KI试纸变蓝,即湿润淀粉碘化钾试纸变蓝能说明Cl2的氧化性强于I2,
故答案为:湿润淀粉碘化钾试纸变蓝.
点评 本题考查氯气的化学性质,为高频考点,把握习题中的信息、物质的氧化性及发生的反应为解答的关键,侧重分析能力与化学用语应用的考查,题目难度不大.

练习册系列答案
 一诺书业暑假作业快乐假期云南美术出版社系列答案
一诺书业暑假作业快乐假期云南美术出版社系列答案
相关题目
2.下列说法不正确的是( )
| A. | 不能自发进行的氧化还原反应,通过电解的原理可以实现 | |
| B. | 电镀时保持电流恒定,升高温度不改变电解反应速率 | |
| C. | 电解精炼铜电解槽底部会形成含少量Ag、Fe、Pt等金属的阳极泥 | |
| D. | 氢氧燃料电池是一种不需要将还原剂和氧化剂全部储藏在电池内的新型发电装置 | |
| E. | MnO2的生产方法之一是以石墨为电极,电解酸化的MnSO4溶液,若电解电路中通过2mol电子,MnO2的理论产量为1mol | |
| F. | 燃料电池是将燃料燃烧所放出的能量转化为化学能的装置 |
20.下列说法正确的是( )
| A. | 不同元素的原子发生跃迁时,会释放不同的光 | |
| B. | 第一电离能与电负性的数值都是以气态中性基态原子为研究对象测得到 | |
| C. | 分子中的原子有固定的空间位置,组成完全相同的分子,由于原子位置的不同会表现出不同的性质 | |
| D. | 两个相同的原子的任意未成对电子的电子云在两个原子核间重叠,形成非极性共价键 |
17. 已知:H2SO3?HSO${\;}_{3}^{-}$+H+ Ka1、HSO${\;}_{3}^{-}$?SO${\;}_{3}^{2-}$+H+ Ka2
已知:H2SO3?HSO${\;}_{3}^{-}$+H+ Ka1、HSO${\;}_{3}^{-}$?SO${\;}_{3}^{2-}$+H+ Ka2
常温下,向某浓度的H2SO3溶液中逐滴加入一定量浓度的NaOH溶液,所得溶液中H2SO3、HSO3-和SO32-三种微粒的物质的量分数与溶液的关系如图所示,则下列说法中不正确的是( )
 已知:H2SO3?HSO${\;}_{3}^{-}$+H+ Ka1、HSO${\;}_{3}^{-}$?SO${\;}_{3}^{2-}$+H+ Ka2
已知:H2SO3?HSO${\;}_{3}^{-}$+H+ Ka1、HSO${\;}_{3}^{-}$?SO${\;}_{3}^{2-}$+H+ Ka2常温下,向某浓度的H2SO3溶液中逐滴加入一定量浓度的NaOH溶液,所得溶液中H2SO3、HSO3-和SO32-三种微粒的物质的量分数与溶液的关系如图所示,则下列说法中不正确的是( )
| A. | 曲线3表示的微粒是SO32- | |
| B. | 溶液pH=4.2时,c(Na+)+c(H+)=c(OH-)+2c(SO32-) | |
| C. | 常温下,$\frac{{K}_{a1}}{{K}_{a2}}$=1000 | |
| D. | 溶液pH=1.2时:c(Na+)+c(H+)=c(OH-)+c(HSO3) |
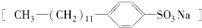 是常用洗涤剂的主要成分.其结构可用图形
是常用洗涤剂的主要成分.其结构可用图形 来表示,•端为链烃基,O端为极性基.根据这一结构特点,试分析和回答下列问题:
来表示,•端为链烃基,O端为极性基.根据这一结构特点,试分析和回答下列问题: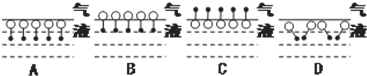
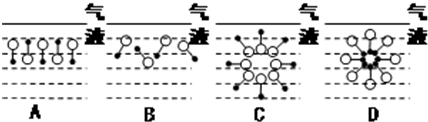
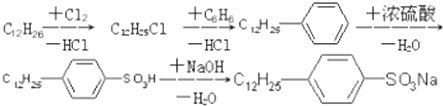
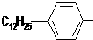 .
.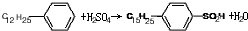 ,反应类型为取代反应.
,反应类型为取代反应.