题目内容
12.有一瓶溶液只含Cl-、CO32-、SO42-、Na+、Mg2+、Cu2+六种离子中的某几种,通过实验:①原溶液加过量的NaOH溶液,产生白色沉淀;
②原溶液中加BaCl2溶液不产生沉淀;
③原溶液中加AgNO3溶液产生白色沉淀,再加稀硝酸白色沉淀不溶解,回答下列问题:
(1)试分析原溶液中一定含有的离子是Mg2+、Cl-,一定不含有的离子是CO32-、SO42-、Cu2+,可能含有的离子是Na+;
(2)有的同学认为实验③可以省略,你认为是否正确是(填“是”或“否”),理由是溶液呈电中性,必须同时含有阴、阳离子,又因为一定无CO32-,SO42-,所以一定有Cl-;
(3)若溶液中确定有Na+,若溶液中c(Mg2+)=0.1mol/L,c(Cl-)=0.3mol/L,则c(Na+)=0.1mol/L.
(4)进行①操作后,过滤所得溶液中一定有的溶质是NaCl、NaOH.
分析 由①原溶液加过量的NaOH溶液,产生白色沉淀,可知一定含Mg2+,不含Cu2+;且CO32-、Mg2+不能共存,则一定不含CO32-;
②原溶液中加BaCl2溶液不产生沉淀,则一定不含SO42-;
③原溶液中加AgNO3溶液产生白色沉淀,再加稀硝酸白色沉淀不溶解,白色沉淀为AgCl,一定含Cl-,以此来解答.
解答 解:由①原溶液加过量的NaOH溶液,产生白色沉淀,可知一定含Mg2+,不含Cu2+;且CO32-、Mg2+不能共存,则一定不含CO32-;
②原溶液中加BaCl2溶液不产生沉淀,则一定不含SO42-;
③原溶液中加AgNO3溶液产生白色沉淀,再加稀硝酸白色沉淀不溶解,白色沉淀为AgCl,一定含Cl-,
(1)原溶液中一定含有的离子是Mg2+、Cl-,一定不含有的离子是CO32-、SO42-、Cu2+,可能含有的离子是Na+,
故答案为:Mg2+、Cl-; CO32-、SO42-、Cu2+; Na+;
(2)实验③可以省略,因溶液呈电中性,必须同时含有阴、阳离子,又因为一定无CO32-,SO42-,所以一定有Cl-,
故答案为:是;溶液呈电中性,必须同时含有阴、阳离子,又因为一定无CO32-,SO42-,所以一定有Cl-;
(3)由溶液显电中性,可知0.1mol/L×2+c(Na+)=0.3mol/L,解得c(Na+)=0.1mol/L,故答案为:0.1mol/L;
(4)由上述分析可知,溶液含Cl-、Na+、Mg2+,加过量NaOH使镁离子转化为沉淀,则过滤后溶液中溶质为NaCl、NaOH,故答案为:NaCl、NaOH.
点评 本题考查无机物的推断,为高频考点,把握离子的检验、离子之间的反应等为解答的关键,侧重分析与推断能力的考查,注意溶液电中性的应用,题目难度不大.

 同步练习强化拓展系列答案
同步练习强化拓展系列答案| A. | 一定条件下,1 molN2与足量的氢气反应合成氨,转移的电子数为6 NA | |
| B. | 常温下,1.0LpH=13的氢氧化钡溶液中OH-的数目为0.2NA | |
| C. | 常温常压下,4.6 g的NO2和N2O4混合物中,含原子总数一定为0.3NA | |
| D. | 1L0.1mol/L Na2CO3溶液中含CO32-数目为0.1NA |
| A. | 单质钠与水的反应:Na+H2O═Na++OH-+H2↑ | |
| B. | 醋酸除水垢:2H++CaCO3═Ca2++H2O+CO2↑ | |
| C. | 氢氧化钡溶液和硫酸铜溶液反应:Ba2++SO42-═BaSO4↓ | |
| D. | 稀硫酸与铁粉反应:Fe+2H+═Fe2++H2↑ |
| A. | 紫色 | B. | 红色 | C. | 蓝色 | D. | 无色 |
| 阳离子 | Na+ Mg2+ Fe3+ Al3+ Fe2+ |
| 阴离子 | OH- CO32- Cl- NO3- SO42- |
②若向原溶液中加入少量稀盐酸,有无色气体生成,该无色气体遇空气变成红棕色,且溶液中阴离子种类不变.
请推断:
(1)原溶液中含有的阳离子是Fe2+、Mg2+; 含有的阴离子是Cl-、NO3-、SO42-.
(2)向原溶液中加入足量稀盐酸发生反应的离子方程式为3Fe2++NO3-+4H+═3Fe3++NO↑+2H2O.
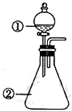 用如图所示装置进行下列实验:将①中溶液滴入②中,预测的现象与实际相符的是( )
用如图所示装置进行下列实验:将①中溶液滴入②中,预测的现象与实际相符的是( )| 选项 | ①中物质 | ②中物质 | 预测②中的现象 |
| A. | 稀盐酸 | 碳酸钠与氢氧化钠的混合溶液 | 立即产生气泡 |
| B. | 浓硫酸 | 用砂纸打磨过的铝条 | 产生刺激性气味气体 |
| C. | 氯化铝溶液 | 浓氢氧化钠溶液 | 产生大量白色沉淀 |
| D. | 草酸溶液 | 高锰酸钾酸性溶液 | 溶液逐渐褪色 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 1molHCl溶液中,H+数目为NA | |
| B. | 常温常压下,8gCH4含有电子数目为5NA | |
| C. | 12gNaHSO4晶体中含有0.3NA个阳离子 | |
| D. | 78g苯含有C=C双键的数目为3 NA |