题目内容
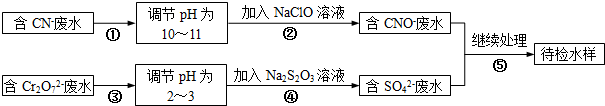
向盛有10mL AlCl3溶液试管,逐渐滴入加NaOH溶液的图象如图,则下列说法不正确的是( )
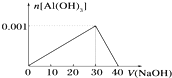

| A、AlCl3溶液的浓度为0.1mol?L-1 |
| B、NaOH溶液的浓度为0.1mol?L-1 |
| C、沉淀最大质量为0.078g |
| D、加入10mL的NaOH溶液与加入38mL的NaOH溶液产生的沉淀质量相同 |
考点:镁、铝的重要化合物
专题:图示题
分析:一定量AlCl3溶液中加入NaOH溶液后,随氢氧化钠溶液的加入,先生成氢氧化铝沉淀,发生:Al3++3OH-=Al(OH)3↓,然后沉淀溶解:Al(OH)3+OH-═AlO2-+2H2O;依据化学方程式的定量关系计算得到.
解答:
解:A、AlCl3溶液的浓度为
=0.1mol?L-1,故A正确;
B、根据反应Al3++3OH-=Al(OH)3↓,n(NaOH)=0.003mol,NaOH溶液的浓度为
=0.1mol?L-1;故B正确
C、分析图象可知,生成0.001molAl(OH)3沉淀,质量为:0.001mol×78g/mol=0.078g,故C正确;
D、加入10mL的NaOH溶液,根据反应Al3++3OH-=Al(OH)3↓,生成Al(OH)3沉淀为0.1mol?L-1×0.01L÷3×78g/mol=0.026g;加入38mL的NaOH溶液,
根据反应Al(OH)3+OH-═AlO2-+2H2O,
0.0008mol 0.008L×0.1mol?L-1
溶解沉淀为0.008mol×78g/mol=0.0625g,剩余沉淀0.078g-0.0625g=0.0155g;故D错误;
故选D.
| 0.001mol |
| 0.01L |
B、根据反应Al3++3OH-=Al(OH)3↓,n(NaOH)=0.003mol,NaOH溶液的浓度为
| 0.003mol |
| 0.03L |
C、分析图象可知,生成0.001molAl(OH)3沉淀,质量为:0.001mol×78g/mol=0.078g,故C正确;
D、加入10mL的NaOH溶液,根据反应Al3++3OH-=Al(OH)3↓,生成Al(OH)3沉淀为0.1mol?L-1×0.01L÷3×78g/mol=0.026g;加入38mL的NaOH溶液,
根据反应Al(OH)3+OH-═AlO2-+2H2O,
0.0008mol 0.008L×0.1mol?L-1
溶解沉淀为0.008mol×78g/mol=0.0625g,剩余沉淀0.078g-0.0625g=0.0155g;故D错误;
故选D.
点评:本题考查了铝及其化合物性质的分析判断和计算应用,侧重于学生的分析能力和计算能力的考查,为高考常见题型和高频考点,明确碱的量的多少对反应的影响及发生的化学反应是解答本题的关键,难度不大.

练习册系列答案
 教育世家状元卷系列答案
教育世家状元卷系列答案 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案 单元加期末复习先锋大考卷系列答案
单元加期末复习先锋大考卷系列答案
相关题目
某固体混合物可能由Al、(NH4)2SO4、MgCl2、FeCl2、AlCl3中的一种或几种组成,现对该混合物做如下实验,所得现象和有关数据如图所示(气体体积数据已换算成标准状况下的体积):下列说法正确的是( )


| A、固体混合物中一定含有Al,但质量不可确定 |
| B、固体混合物中一定不含有AlCl3 |
| C、固体混合物中一定含有MgCl2和FeCl2 |
| D、固体混合物中一定含有 (NH4)2SO4和MgCl2,且物质的量之比为1:1 |
在以Al2O3为原料制备Al(OH)3可以使用如下路线:Al2O3
AlCl3
Al(OH)3,则X最适宜用的试剂( )
| HCl |
| X |
| A、NH3?H2O |
| B、CO2 |
| C、NaOH |
| D、HCl |
下列推断合理的是( )
| A、明矾[KAl(SO4)2?12H2O]在水中能形成Al(OH)3胶体,可用作净水剂 |
| B、Na的金属活性比Mg强,故可用Na与MgCl2溶液反应制Mg |
| C、浓H2SO4有强氧化性,但不能与Cu发生反应 |
| D、SO2具有还原性,故可作漂白剂 |