题目内容
元素周期表与元素周期律在学习、研究和生产实践中有很重要的作用.下表列出了①~⑨九种元素在周期表中的位置.
请回答:
(1)这九种元素分别是① (填元素符号,下同)、② 、③ 、④ 、⑤ 、⑥ 、⑦ 、⑧ 、⑨ ,其中化学性质最不活泼的是 .
(2)在①、②、③三种元素的氧化物对应的水化物中,碱性最强的是 (填化学式).
(3)①、②、③三种元素按原子半径由大到小的顺序依次为 (填元素符号).
(4)⑥元素的氢化物是 (填化学式),该氢化物在常温下与②发生反应的化学方程式为 ,所得溶液的pH (填“<”、“>”或“=”)7.
(5)⑧元素与①元素形成的化合物是 (填化学式),高温下灼烧该化合物时,火焰呈 色.
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ⑤ | ⑥ | ||||||
| 3 | ① | ③ | ④ | ⑦ | ⑨ | |||
| 4 | ② | ⑧ |
(1)这九种元素分别是①
(2)在①、②、③三种元素的氧化物对应的水化物中,碱性最强的是
| 实验步骤 | 实验结论 |
| ①氯水+1mLCCl4,振荡,静置,观察四氯化碳层颜色 | 氧化性从强到弱的顺序:氯、溴、 |
| ②NaBr溶液+氯水+1mLCCl4,振荡,静置,观察四氯化碳层颜色 | |
| ③KI溶液++氯水+1mLCCl4,振荡,静置,观察四氯化碳层颜色 |
(4)⑥元素的氢化物是
(5)⑧元素与①元素形成的化合物是
考点:元素周期律和元素周期表的综合应用,同一主族内元素性质递变规律与原子结构的关系
专题:
分析:(1)根据元素周期表中元素的分布来确定元素;
(2)同主族从上到下,元素的金属性越强,同周期从右到左,元素的金属性越强,金属性越强,碱性越强;
(3)同主族从上到下,原子半径逐渐增大,同周期从右到左,原子半径逐渐增大.
(4)金属钾可以和水之间反应生成氢氧化钾和氢气;
(5)含有钠元素的焰色反应呈现黄色.
(2)同主族从上到下,元素的金属性越强,同周期从右到左,元素的金属性越强,金属性越强,碱性越强;
(3)同主族从上到下,原子半径逐渐增大,同周期从右到左,原子半径逐渐增大.
(4)金属钾可以和水之间反应生成氢氧化钾和氢气;
(5)含有钠元素的焰色反应呈现黄色.
解答:
解:(1)根据元素周期表中元素的分布,确定各元素分别是:①是Na,②是K,③是Mg,④是Al,⑤是C,⑥是O,⑦是Cl,⑧是Br,⑨是Ar,其中的Ar是惰性气体,化学性质最稳定,故答案为:Na;K;Mg;Al;C;O;Cl;Br;Ar;Ar;
(2)同主族从上到下,元素的金属性越强,同周期从右到左,元素的金属性越强,金属性越强,碱性越强,所以碱性最强的是KOH,故答案为:KOH;
(3)同主族从上到下,原子半径逐渐增大,同周期从右到左,原子半径逐渐增大,所以原子半径顺序是K>Na>Mg,故答案为:K>Na>Mg.
(4)O元素的氢化物是H2O,金属钾可以和水之间反应生成氢氧化钾和氢气,即2K+2H2O=2KOH+H2↑,得到的氢氧化钾溶液是强碱,pH大于7,
故答案为:H2O;2K+2H2O=2KOH+H2↑;>;
(5)Br元素与Na元素形成的化合物NaBr,含有钠元素的焰色反应呈现黄色,故答案为:NaBr,黄.
(2)同主族从上到下,元素的金属性越强,同周期从右到左,元素的金属性越强,金属性越强,碱性越强,所以碱性最强的是KOH,故答案为:KOH;
(3)同主族从上到下,原子半径逐渐增大,同周期从右到左,原子半径逐渐增大,所以原子半径顺序是K>Na>Mg,故答案为:K>Na>Mg.
(4)O元素的氢化物是H2O,金属钾可以和水之间反应生成氢氧化钾和氢气,即2K+2H2O=2KOH+H2↑,得到的氢氧化钾溶液是强碱,pH大于7,
故答案为:H2O;2K+2H2O=2KOH+H2↑;>;
(5)Br元素与Na元素形成的化合物NaBr,含有钠元素的焰色反应呈现黄色,故答案为:NaBr,黄.
点评:本题考查学生元素在周期表中的位置以及元素周期律及元素化合物的相关知识,综合性强,难度大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
设NA为阿伏加德罗常数,下列说法正确的是( )
| A、23 g钠在氧气中完全燃烧失电子数为0.5NA |
| B、46gNO2和N2O4混合气体中含有氮原子数为1NA~2NA |
| C、标准状况下,11.2L的SO3所含分子数为0.5 NA |
| D、室温下,16g甲烷含有共价键数为4 NA |
下列实验操作现象与图象所示不相对应的是( )
A、 往AlCl3溶液中逐滴加入NaOH溶液至过量 |
B、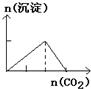 往澄清石灰水中缓慢通入CO2气体至过量 |
C、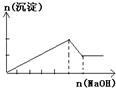 往含MgCl2、AlCl3各1mol的混合溶液中逐滴加入NaOH溶液至过量 |
D、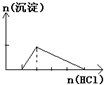 往NaOH和NaAlO2混合溶液中逐滴加入盐酸至过量 |
下列各组离子在水溶液中不能大量共存的是( )
| A、H+ K+ Cl- NO3- |
| B、K+ Al3+ Cl- CO32- |
| C、K+ Na+ CO32- NO3- |
| D、Al3+ Cu2+ SO42- Cl- |
在以Al2O3为原料制备Al(OH)3可以使用如下路线:Al2O3
AlCl3
Al(OH)3,则X最适宜用的试剂( )
| HCl |
| X |
| A、NH3?H2O |
| B、CO2 |
| C、NaOH |
| D、HCl |