题目内容
12.NH3是重要的化工原料,已知:(1)N2(g)+O2(g)═2NO(g)△H=+a kJ/mol ①
(2)4NH3(g)+5O2(g)═4NO(g)+6H20(g)△H=-b kJ/mol ②
(3)2H2(g)+O2(g)═2H2O(g)△H=-c kJ/mol ③
则 N2(g)+3H2(g)═2NH3(g)的△H 是( )
| A. | (a+0.5b-1.5c)kJ/mol | B. | (a-2.5b+1.5c )kJ/mol | ||
| C. | (2a+3b-2c)kJ/mol | D. | (2c+b-a)kJ/mol |
分析 根据盖斯定律可知,由所给的反应,将①+$\frac{②}{2}$-$\frac{③×3}{2}$可得所要求的反应,反应热做相应的变化即可.
解答 解:已知:N2(g)+O2(g)═2NO(g)△H=+a kJ/mol ①
4NH3(g)+5O2(g)═4NO(g)+6H20(g)△H=-b kJ/mol ②
2H2(g)+O2(g)═2H2O(g)△H=-c kJ/mol ③
根据盖斯定律可知,由所给的反应,将①+$\frac{②}{2}$-$\frac{③×3}{2}$可得:N2(g)+3H2(g)═2NH3(g)△H=(a+0.5b-1.5c)kJ/mol
故选A.
点评 本题考查了热化学方程式的书写方法和盖斯定律的计算应用,题目较简单.

练习册系列答案
 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案
相关题目
2.下列装置所示的实验中,能达到实验目的是( )
| A. | 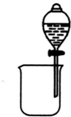 分离碘酒中的碘和酒精 | B. | 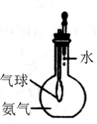 验证氨气易溶于水 | ||
| C. | 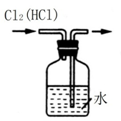 除去Cl2中的HCl杂质 | D. | 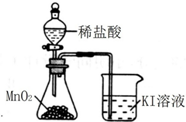 比较MnO2、Cl2、I2 |
3.实验用含有杂质(FeO、Fe2O3)的废CuO制备胆矾晶体经历下列过程,Fe3+在pH=5时已完全沉淀.其分析错误的是( )


| A. | 洗涤晶体:向滤出晶体的漏斗中加少量冷水浸没晶体,自然流下,重复2-3次 | |
| B. | 用18mol/L浓硫酸配制溶解所用4mol/L的稀硫酸,玻璃仪器一般只有3种 | |
| C. | 利用Cu(OH)2替代CuO也可调试溶液pH,不影响实验结果 | |
| D. | 若要测定所得硫酸铜晶体中结晶水的数目,在实验中要用到坩埚和坩埚钳 |
7.硝酸与金属反应往往产生氮氧化物,但是在某些特殊情况则不然.将稀硝酸(HNO3浓度低于2mol•L-1)与过量金属镁缓和反应放出气体A,反应完全后向剩余溶液中加入过量NaOH固体并加热,放出气体B,将两次放出气体全部收集并混合,用碱石灰干燥后缓慢通过足量的灼热氧化铜固体,观察到固体变红,将剩余气体用浓硫酸干燥,气体体积变为原来的三分之一,则下列分析不正确的是(本题中所有气体体积均为相同条件下测得的体积)( )
| A. | 灼热氧化铜变红过程发生的反应有2NH3+3CuO$\frac{\underline{\;\;△\;\;}}{\;}$N2+3H2O+3Cu | |
| B. | 气体A为H2;气体B为NH3 | |
| C. | 气体A与气体B的体积比为1:2 | |
| D. | 在镁与硝酸反应过程中还原剂与氧化剂的物质的量之比为3:2 |
17.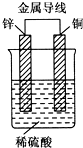 锌、铜和稀硫酸形成的原电池,某实验兴趣小组同学做完实验后,在读书卡片上记录如下:
锌、铜和稀硫酸形成的原电池,某实验兴趣小组同学做完实验后,在读书卡片上记录如下:
卡片上的描述合理的是( )
 锌、铜和稀硫酸形成的原电池,某实验兴趣小组同学做完实验后,在读书卡片上记录如下:
锌、铜和稀硫酸形成的原电池,某实验兴趣小组同学做完实验后,在读书卡片上记录如下:
卡片上的描述合理的是( )
| A. | ①②③ | B. | ③④⑤ | C. | ①⑤⑥ | D. | ②③④ |
4.关于化学式[TiCl(H2O)5]Cl2•H2O的配合物的下列说法中正确的是( )
| A. | 配位体是Cl-和H2O,配位数是8 | |
| B. | 中心离子是Ti4+,配离子是[TiCl(H2O)5]2+ | |
| C. | 内界和外界中的Cl-的数目比是1:2 | |
| D. | 在1mol该配合物中加入足量AgNO3溶液,可以得到3molAgCl沉淀 |
1.下列解释事实的方程式不正确的是( )
| A. | 碳酸钠溶液显碱性:CO32-+H2O?HCO3-+OH- | |
| B. | 0.1 mol•L-1氨水的pH为11:NH3•H2O?NH4++OH- | |
| C. | “84消毒液”和“洁厕灵”(主要成分为盐酸)混合使用会产生有毒气体:ClO${\;}_{3}^{-}$+5Cl-+6H+=3Cl2↑+3H2O | |
| D. | 一定条件下,0.1 mol N2和0.3 mol H2充分反应放出热量小于9.2 kJ:N2(g)+3H2(g)?2NH3(g)△H=-92 kJ•mol-1 |
2.下列操作中能使电离平衡H2O?H++OH-向右移动,且溶液中c(H+)增大的是( )
| A. | 向水中加入K2CO3溶液 | B. | 向水中加入AlCl3固体 | ||
| C. | 向水中加入NaHSO4溶液 | D. | 向水中加入NaOH固体 |