题目内容
4.关于化学式[TiCl(H2O)5]Cl2•H2O的配合物的下列说法中正确的是( )| A. | 配位体是Cl-和H2O,配位数是8 | |
| B. | 中心离子是Ti4+,配离子是[TiCl(H2O)5]2+ | |
| C. | 内界和外界中的Cl-的数目比是1:2 | |
| D. | 在1mol该配合物中加入足量AgNO3溶液,可以得到3molAgCl沉淀 |
分析 A.配体含有孤对电子,中心原子或离子含有空轨道,Ti3+的配位数为6;
B.由化合价代数和为0可知,中心离子是Ti3+;
C.内界和外界中的Cl-的数目分别为1、2;
D.内界配体Cl-不与Ag+反应,外界Cl-离子与Ag+反应.
解答 解:A.配合物[TiCl(H2O)5]Cl2•H2O,配位体是Cl和H2O,Ti3+的配位数为6,故A错误;
B.配离子是[TiCl(H2O)5]2+,但中心离子是Ti3+,故B错误;
C.配合物[TiCl(H2O)5]Cl2•H2O,内界配体Cl-为1,外界Cl-为2,内界和外界中的Cl-的数目比是1:2,故C正确;
D.内界配体Cl-不与Ag+反应,外界Cl-离子与Ag+反应,在1mol该配合物中加入足量AgNO3溶液,可以得到2molAgCl沉淀,故D错误;
故选C.
点评 本题考查配合物,注意配合物形成:配体含有孤对电子,中心原子或离子含有空轨道,配体和外界离子性质不同,题目难度中等.

练习册系列答案
相关题目
12.NH3是重要的化工原料,已知:
(1)N2(g)+O2(g)═2NO(g)△H=+a kJ/mol ①
(2)4NH3(g)+5O2(g)═4NO(g)+6H20(g)△H=-b kJ/mol ②
(3)2H2(g)+O2(g)═2H2O(g)△H=-c kJ/mol ③
则 N2(g)+3H2(g)═2NH3(g)的△H 是( )
(1)N2(g)+O2(g)═2NO(g)△H=+a kJ/mol ①
(2)4NH3(g)+5O2(g)═4NO(g)+6H20(g)△H=-b kJ/mol ②
(3)2H2(g)+O2(g)═2H2O(g)△H=-c kJ/mol ③
则 N2(g)+3H2(g)═2NH3(g)的△H 是( )
| A. | (a+0.5b-1.5c)kJ/mol | B. | (a-2.5b+1.5c )kJ/mol | ||
| C. | (2a+3b-2c)kJ/mol | D. | (2c+b-a)kJ/mol |
19.相同条件下,因溶液浓度不同,化学反应方程式表达可能不同的是( )
| A. | Zn与硫酸铜 | B. | Cu与硝酸 | C. | Mg与盐酸 | D. | Al与氢氧化钠 |
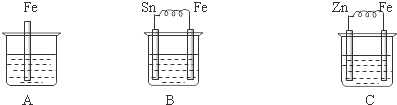
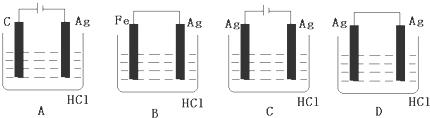
9.关于如图所示各装置的叙述中,正确的是( )
| A. | 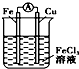 装置是原电池,总反应是:Cu+2Fe3+═Cu2++2Fe2 | |
| B. |  装置研究的是金属的析氢腐蚀,Fe上的反应为Fe-2e-═Fe2+ | |
| C. | 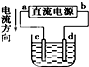 若用装置精炼铜,则d极为粗铜,c极为纯铜,电解质溶液为CuSO4溶液 | |
| D. | 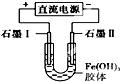 装置通电一段时间后石墨Ⅱ电极附近溶液红褐色加深 |
13.将等质量的铜片在酒精灯上加热后,分别插入下列溶液后静置片刻,铜片质量增加的是( )
| A. | 醋酸 | B. | 无水乙醇 | C. | 石灰水 | D. | 盐酸 |
14.下列物质属于两性氧化物的是( )
| A. | CaO | B. | S02 | C. | A1203 | D. | A1(0H)3 |