题目内容
20.请选“>”、“<”或“=”填写下列空格中:(1)电负性:N<O;
(2)硬度:金刚石>碳化硅;
(3)晶格能:CaO>BaO.
分析 (1)同周期自左而右元素电负性增大;
(2)金刚石与碳化硅均为原子晶体,原子半径越小,共价键越稳定性,移动越大;
(3)钙离子、钡离子离子所带电荷相同,离子半径越小,晶格能越大.
解答 解:(1)同周期自左而右元素电负性增大,故电负性:N<O,故答案为:<;
(2)金刚石与碳化硅均为原子晶体,原子半径C<Si,故C-C键长<C-Si键长,C-C键更稳定,则硬度:金刚石>碳化硅,故答案为:>;
(3)钙离子、钡离子所带电荷相同,钙离子半径大于钡离子的,故晶格能CaO>BaO,故答案为:>.
点评 本题考查电负性、晶体类型与性质,注意理解元素周期律,掌握晶体类型与硬度、熔沸点比较.

练习册系列答案
 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案
相关题目
11.下列说法正确的是( )
| A. | 某雨水样品放置一段时间后pH减小是因为水中溶解的CO2增多 | |
| B. | 雾霾成因与田间焚烧秸秆和燃烧煤炭无关 | |
| C. | SO2能使溴水褪色,也能高锰酸钾溶液褪色,都体现了SO2的漂白性 | |
| D. | 常温下,浓硫酸和浓硝酸可以用铝槽车或铁槽车装运 |
5.下列实验操作、实验现象、解释或结论不对应的是( )
| 选项 | 实验操作 | 实验现象 | 解释或结论 |
| A | 将蘸有浓硫酸的玻璃棒与蘸有浓氨水的玻璃棒靠近 | 无明显现象 | 氨气与硫酸不反应 |
| B | 用干净的铂丝蘸取某溶液,在酒精灯火焰上灼烧 | 透过蓝色钴玻璃片可以看到紫色的火焰 | 该溶液中有钾离子 |
| C | 在导管口点燃纯净的氢气,然后将导管伸入盛满氯气的集气瓶中 | 产生苍白色火焰 | 物质燃烧不一定需要氧气 |
| D | 加热试管中的氯化铵固体 | 试管底部的固体逐渐消失 | 氯化铵受热分解 |
| A. | A | B. | B | C. | C | D. | D |
12.NH3是重要的化工原料,已知:
(1)N2(g)+O2(g)═2NO(g)△H=+a kJ/mol ①
(2)4NH3(g)+5O2(g)═4NO(g)+6H20(g)△H=-b kJ/mol ②
(3)2H2(g)+O2(g)═2H2O(g)△H=-c kJ/mol ③
则 N2(g)+3H2(g)═2NH3(g)的△H 是( )
(1)N2(g)+O2(g)═2NO(g)△H=+a kJ/mol ①
(2)4NH3(g)+5O2(g)═4NO(g)+6H20(g)△H=-b kJ/mol ②
(3)2H2(g)+O2(g)═2H2O(g)△H=-c kJ/mol ③
则 N2(g)+3H2(g)═2NH3(g)的△H 是( )
| A. | (a+0.5b-1.5c)kJ/mol | B. | (a-2.5b+1.5c )kJ/mol | ||
| C. | (2a+3b-2c)kJ/mol | D. | (2c+b-a)kJ/mol |
9.关于如图所示各装置的叙述中,正确的是( )
| A. | 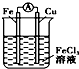 装置是原电池,总反应是:Cu+2Fe3+═Cu2++2Fe2 | |
| B. |  装置研究的是金属的析氢腐蚀,Fe上的反应为Fe-2e-═Fe2+ | |
| C. | 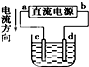 若用装置精炼铜,则d极为粗铜,c极为纯铜,电解质溶液为CuSO4溶液 | |
| D. | 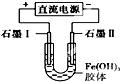 装置通电一段时间后石墨Ⅱ电极附近溶液红褐色加深 |
10.下列物质不属于合金的是( )
| A. | 钢 | B. | 水银 | C. | 黄铜 | D. | 硬铝 |
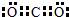 ,Z3+的原子结构示意图为
,Z3+的原子结构示意图为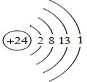
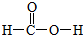 ,m g该物质完全燃烧后通过足量Na2O2固体吸收,Na2O2固体增重的质量为$\frac{15m}{23}$g.
,m g该物质完全燃烧后通过足量Na2O2固体吸收,Na2O2固体增重的质量为$\frac{15m}{23}$g.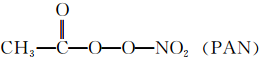 等二次污染物.
等二次污染物.