题目内容
17.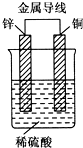 锌、铜和稀硫酸形成的原电池,某实验兴趣小组同学做完实验后,在读书卡片上记录如下:
锌、铜和稀硫酸形成的原电池,某实验兴趣小组同学做完实验后,在读书卡片上记录如下:
卡片上的描述合理的是( )
| A. | ①②③ | B. | ③④⑤ | C. | ①⑤⑥ | D. | ②③④ |
分析 Zn-Cu原电池中,Zn作负极,负极上锌失电子生成锌离子,Cu作正极,正极上氢离子得电子,电子由负极流向正极,阳离子向正极移动,以此来解答.
解答 解:①Zn为负极,Cu为正极,故①错误;
②H+向正极移动,故②错误;
③电子由Zn电极流向Cu电极,故③正确;
④Cu电极上发生2H++2e-=H2↑,故④正确;
⑤由2H++2e-=H2↑可知,有1mol电子流向导线,产生氢气0.5mol,故⑤正确;
⑥正极反应为2H++2e-=H2↑,故⑥错误;
故选B.
点评 本题考查原电池的原理,明确电极的判断、发生的电极反应、电子、离子的移动方向即可解答,题目难度不大.

练习册系列答案
相关题目
5.下列实验操作、实验现象、解释或结论不对应的是( )
| 选项 | 实验操作 | 实验现象 | 解释或结论 |
| A | 将蘸有浓硫酸的玻璃棒与蘸有浓氨水的玻璃棒靠近 | 无明显现象 | 氨气与硫酸不反应 |
| B | 用干净的铂丝蘸取某溶液,在酒精灯火焰上灼烧 | 透过蓝色钴玻璃片可以看到紫色的火焰 | 该溶液中有钾离子 |
| C | 在导管口点燃纯净的氢气,然后将导管伸入盛满氯气的集气瓶中 | 产生苍白色火焰 | 物质燃烧不一定需要氧气 |
| D | 加热试管中的氯化铵固体 | 试管底部的固体逐渐消失 | 氯化铵受热分解 |
| A. | A | B. | B | C. | C | D. | D |
12.NH3是重要的化工原料,已知:
(1)N2(g)+O2(g)═2NO(g)△H=+a kJ/mol ①
(2)4NH3(g)+5O2(g)═4NO(g)+6H20(g)△H=-b kJ/mol ②
(3)2H2(g)+O2(g)═2H2O(g)△H=-c kJ/mol ③
则 N2(g)+3H2(g)═2NH3(g)的△H 是( )
(1)N2(g)+O2(g)═2NO(g)△H=+a kJ/mol ①
(2)4NH3(g)+5O2(g)═4NO(g)+6H20(g)△H=-b kJ/mol ②
(3)2H2(g)+O2(g)═2H2O(g)△H=-c kJ/mol ③
则 N2(g)+3H2(g)═2NH3(g)的△H 是( )
| A. | (a+0.5b-1.5c)kJ/mol | B. | (a-2.5b+1.5c )kJ/mol | ||
| C. | (2a+3b-2c)kJ/mol | D. | (2c+b-a)kJ/mol |
9.关于如图所示各装置的叙述中,正确的是( )
| A. | 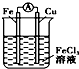 装置是原电池,总反应是:Cu+2Fe3+═Cu2++2Fe2 | |
| B. |  装置研究的是金属的析氢腐蚀,Fe上的反应为Fe-2e-═Fe2+ | |
| C. | 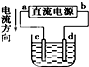 若用装置精炼铜,则d极为粗铜,c极为纯铜,电解质溶液为CuSO4溶液 | |
| D. | 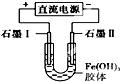 装置通电一段时间后石墨Ⅱ电极附近溶液红褐色加深 |
7.下列关于工业合成氨的叙述正确的是( )
| A. | 合成氨工业温度选择为700K左右,只要是为了提高NH3产率 | |
| B. | 使用催化剂和施加高压,都能提高反应速率,但对化学平衡状态无影响 | |
| C. | 合成氨生产过程中将NH3液化分离,可提高N2、H2的转化率 | |
| D. | 合成氨工业中为了提高氢气的利用率,可适当增加氢气浓度 |
 某研究小组为探究SO2和Fe(NO3)3溶液的反应的实质.设计了如图所示装置进行实验.已知:1.0mol/L的Fe(NO3)3溶液的pH=1.
某研究小组为探究SO2和Fe(NO3)3溶液的反应的实质.设计了如图所示装置进行实验.已知:1.0mol/L的Fe(NO3)3溶液的pH=1.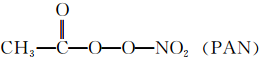 等二次污染物.
等二次污染物. 在能源日趋紧张的今天,科学工作者一直在研究如何提高现有化石能源的利用率,同时寻找开发清洁可再生能源.常采用的方法有煤的气化、煤的液化、设计燃料电池等.
在能源日趋紧张的今天,科学工作者一直在研究如何提高现有化石能源的利用率,同时寻找开发清洁可再生能源.常采用的方法有煤的气化、煤的液化、设计燃料电池等. 钛(Ti)被称为继铁、铝之后的第三金属.
钛(Ti)被称为继铁、铝之后的第三金属.