题目内容
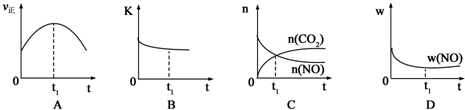
2.一定条件下,可逆反应N2+3H2═2NH3△H<0 达到平衡后,只改变一个条件,下列叙述错误的是( )| A. | 加催化剂,v正、v逆 都发生变化,且变化的倍数相等 | |
| B. | 加压,v正、v逆 都增大,且v正 增大的倍数大于V逆增大的倍数 | |
| C. | 增大氮气的浓度,N2的平衡转化率减小,H2的平衡转化率增大 | |
| D. | 降温,v正、v逆 都减小,且v正 减小的倍数大于v逆减小的倍数 |
分析 该反应是一个反应前后气体体积减小的、放热反应,根据温度、压强、催化剂对反应速率和化学平衡的影响来分析解答.
解答 解:A.催化剂能同等程度的改变正逆反应速率,故A正确;
B.增大压强,正逆反应速率都增大,但v正增大的倍数大于v逆增大的倍数,则平衡向正反应方向移动,故B正确;
C.增加一种反应物的浓度本身转化率减小,另一种物质的转化率变大,所以增大氮气的浓度,N2的平衡转化率减小,H2的平衡转化率增大,故C正确;
D.降低温度,正逆反应速率都减小,但正反应速率减小的倍数小于v逆减小的倍数,则平衡向正反应方向移动,故D错误;
故选D.
点评 本题考查了外界条件对化学反应速率和化学平衡的影响,易错选项是C,增加一种反应物的浓度本身转化率减小,另一种物质的转化率变大,为易错点.

练习册系列答案
 互动英语系列答案
互动英语系列答案
相关题目
13.某研究性学习小组为探究碳酸钠和碳酸氢钠两种物质的性质和用途,进行了如下图所示实验:
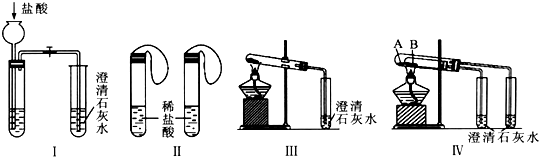
(1)若用实验Ⅳ来验证碳酸钠和碳酸氢钠的热稳定性,则试管B中装入的固体最好是NaHCO3,实验现象是右边试管中的石灰水不变浑浊,而左边试管中的石灰水变浑浊.
(2)若用实验来鉴别碳酸钠和碳酸氢钠两种固体,能达到实验目的是Ⅱ、Ⅲ、Ⅳ(填装置序号).其中能够说明泡沫灭火器中选择碳酸氢钠与酸反应制CO2而不选择碳酸钠的实验是Ⅱ.
(3)若测定Na2CO3固体中混有的少量NaHCO3的质量分数,Ⅲ能否达到实验目的?若能,请说明其计算所需的数据能;若不能,请简要说明理由固体样品的质量和沉淀总质量(或反应前后固体的质量).
(4)同学们将两种固体分别配制成0.5 mol•L-1的溶液,设计如下方案并对反应现象作出预测:

(1)若用实验Ⅳ来验证碳酸钠和碳酸氢钠的热稳定性,则试管B中装入的固体最好是NaHCO3,实验现象是右边试管中的石灰水不变浑浊,而左边试管中的石灰水变浑浊.
(2)若用实验来鉴别碳酸钠和碳酸氢钠两种固体,能达到实验目的是Ⅱ、Ⅲ、Ⅳ(填装置序号).其中能够说明泡沫灭火器中选择碳酸氢钠与酸反应制CO2而不选择碳酸钠的实验是Ⅱ.
(3)若测定Na2CO3固体中混有的少量NaHCO3的质量分数,Ⅲ能否达到实验目的?若能,请说明其计算所需的数据能;若不能,请简要说明理由固体样品的质量和沉淀总质量(或反应前后固体的质量).
(4)同学们将两种固体分别配制成0.5 mol•L-1的溶液,设计如下方案并对反应现象作出预测:
| 实验方案 | 预测现象 | 预测依据 |
| 操作1:向2 mL Na2CO3溶液中滴加1 mL 0.5 mol•L-1 CaCl2溶液 | 有白色沉淀 | Na2CO3溶液中的CO32-浓度较大,能与CaCl2发生反应Ca2++CO32-=CaCO3↓(写离子方程式) |
| 操作2:向2 mL NaHCO3溶液中滴加1 mL 0.5 mol•L-1 CaCl2溶液 | 无白色沉淀 | NaHCO3溶液中的CO32-浓度很小,不能与CaCl2反应 |
10.在体积为V L的密闭容器中通入a mol NO和b mol O2,反应后容器中氮原子数和氧原子数之比为( )
| A. | $\frac{a}{b}$ | B. | $\frac{a}{2b}$ | C. | $\frac{a}{a+2b}$ | D. | $\frac{b}{a}$ |
17.关于下列变化过程的有关叙述正确的是( )


| A. | 苯氧乙酸甲酯的分子式为C9H10O3 | |
| B. | 苯氧乙酸与邻羟基苯乙酸不互为同分异构体 | |
| C. | 苯酚和邻羟基苯乙酸可用FeCl3溶液检验 | |
| D. | ClCH2COOH与足量烧碱溶液共热所得有机物为HOCH2COOH |
14.德国科学家最近研究证实,单一不饱和脂肪酸可有效降低低密度脂蛋白胆固醇含量.在摄入足够的这种脂肪酸的前提下,适当进食脂肪并不会对人体内的胆固醇含量产生不良影响.花生四烯酸(Arachidonicacid,简称AA)即5,8,11,14-二十碳烯酸,其分子式可表示为C19H31COOH,它是人体中最重要的一种多不饱和脂肪酸(PUPA),是人体“必需脂肪酸”之一.以下关于它的说法中不正确的是( )
| A. | 每摩尔花生四烯酸最多可与4 mol溴发生加成反应 | |
| B. | 它可以使酸性高锰酸钾溶液褪色 | |
| C. | 它可与乙醇发生酯化反应 | |
| D. | 它是食醋的主要成分 |
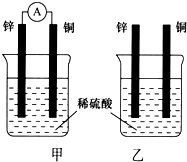 分别按下图甲、乙所示装置进行实验,图中两个烧杯里的溶液为同浓度的稀硫酸,甲中A为电流表.请回答下列问题:
分别按下图甲、乙所示装置进行实验,图中两个烧杯里的溶液为同浓度的稀硫酸,甲中A为电流表.请回答下列问题:
 .
.