题目内容
17.关于下列变化过程的有关叙述正确的是( )
| A. | 苯氧乙酸甲酯的分子式为C9H10O3 | |
| B. | 苯氧乙酸与邻羟基苯乙酸不互为同分异构体 | |
| C. | 苯酚和邻羟基苯乙酸可用FeCl3溶液检验 | |
| D. | ClCH2COOH与足量烧碱溶液共热所得有机物为HOCH2COOH |
分析 A.由结构可知分子式;
B.苯氧乙酸与邻羟基苯乙酸的分子式相同,结构不同;
C.苯酚和邻羟基苯乙酸均含酚-OH;
D.ClCH2COOH与足量烧碱溶液共热,-Cl、-COOH均反应.
解答 解:A.由结构可知苯氧乙酸甲酯的分子式为C9H10O3,故A正确;
B.苯氧乙酸与邻羟基苯乙酸的分子式相同,结构不同,二者互为同分异构体,故B错误;
C.苯酚和邻羟基苯乙酸均含酚-OH,氯化铁溶液不能鉴别,故C错误;
D.ClCH2COOH与足量烧碱溶液共热,-Cl、-COOH均反应,则ClCH2COOH与足量烧碱溶液共热所得有机物为HOCH2COONa,故D错误;
故选A.
点评 本题考查有机物的结构与性质,为高频考点,把握官能团与性质的关系为解答的关键,侧重酚、醇、羧酸性质及分析与应用能力的考查,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
8.标准状况下,n L NH3气体溶于m mL H2O中,得密度为ρ g•cm-3的R L的氨水,则此氨水的物质的量浓度为( )
| A. | $\frac{n}{2.4R}$ mol•L-1 | B. | $\frac{1000nρ}{17n+22.4m}$mol•L-1 | ||
| C. | $\frac{n}{22.4}$mol•L-1 | D. | $\frac{1000ρ}{17n+22.4m}$mol•L-1 |
5.“塑料袋--想说爱你不容易!”自1902年10月24 奥地利科学家马克斯•舒施尼发明它以来,也只有短短的一百多年时间.这些花花绿绿、大大小小的塑料袋,不仅破坏城市景观,对环境的危害也是极惊人的.2008年6月1日起,根据国务院要求,所有超市、商场、集贸市场等商品零售场所实行塑料购物袋有偿使用.下列说法正确的是( )
| A. | 聚丙烯塑料的结构简式为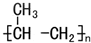 | |
| B. | 聚氯乙烯塑料单体的电子式为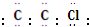 | |
| C. | 塑料购物袋的生产原料需要消耗大量木材 | |
| D. | 聚乙烯中含碳质量分数与其单体的含碳质量分数相同 |
12. 镁、铝、锌是生活中常见的三种金属,查阅资料获得如下信息:
镁、铝、锌是生活中常见的三种金属,查阅资料获得如下信息:
①镁、铝、锌都是银白色的金属
②锌(Zn)可以与NaOH溶液反应生成H2
③Zn(OH)2为白色固体,难溶于水,可溶于强碱及NH3•H2O
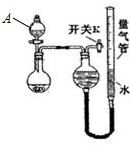
④Zn2+易形成配合物如[Zn(NH3)4]2+,该配合物遇强酸分解生成Zn2+、NH4+(1)(1)甲同学取镁铝合金进行定量分析,用图所示装置进行实验,获得如下数据(所有气体体积均已换算成标准状况,忽略滴入液体体积对气体体积的影响)
(2)乙同学取镁铝锌合金设计如下实验方案:
(可用试剂:样品、pH试纸、稀硫酸、NaOH溶液、氨水)
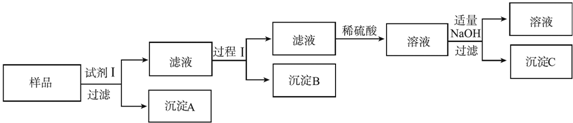
①试剂Ⅰ是NaOH溶液;沉淀B是Al(OH)3.
②过程Ⅰ是:在滤液中逐滴加入稀硫酸,直至生成的沉淀刚好溶解,再加入足量的稀氨水,过滤.
③沉淀C与氨水反应的离子方程式为Zn(OH)2+4NH3=[Zn(NH3)4]2++2OH-;或Zn(OH)2+4NH3•H2O=[Zn(NH3)4]2++2OH-+4H2O.
 镁、铝、锌是生活中常见的三种金属,查阅资料获得如下信息:
镁、铝、锌是生活中常见的三种金属,查阅资料获得如下信息:①镁、铝、锌都是银白色的金属
②锌(Zn)可以与NaOH溶液反应生成H2
③Zn(OH)2为白色固体,难溶于水,可溶于强碱及NH3•H2O
④Zn2+易形成配合物如[Zn(NH3)4]2+,该配合物遇强酸分解生成Zn2+、NH4+(1)(1)甲同学取镁铝合金进行定量分析,用图所示装置进行实验,获得如下数据(所有气体体积均已换算成标准状况,忽略滴入液体体积对气体体积的影响)
| 编号 | 粉末质量 | 量气管第一次读数 | 量气管第二次读数 |
| ① | 2.0 g | 10.0 mL | 346.2 mL |
| ② | 2.0 g | 10.0 mL | 335.0 mL |
| ③ | 2.0 g | 10.0 mL | 345.8 mL |
(可用试剂:样品、pH试纸、稀硫酸、NaOH溶液、氨水)

①试剂Ⅰ是NaOH溶液;沉淀B是Al(OH)3.
②过程Ⅰ是:在滤液中逐滴加入稀硫酸,直至生成的沉淀刚好溶解,再加入足量的稀氨水,过滤.
③沉淀C与氨水反应的离子方程式为Zn(OH)2+4NH3=[Zn(NH3)4]2++2OH-;或Zn(OH)2+4NH3•H2O=[Zn(NH3)4]2++2OH-+4H2O.
2.一定条件下,可逆反应N2+3H2═2NH3△H<0 达到平衡后,只改变一个条件,下列叙述错误的是( )
| A. | 加催化剂,v正、v逆 都发生变化,且变化的倍数相等 | |
| B. | 加压,v正、v逆 都增大,且v正 增大的倍数大于V逆增大的倍数 | |
| C. | 增大氮气的浓度,N2的平衡转化率减小,H2的平衡转化率增大 | |
| D. | 降温,v正、v逆 都减小,且v正 减小的倍数大于v逆减小的倍数 |
9.铁的常见化合价有+2和+3.据研究,铁在浓HNO3中发生钝化时,可生成一种化学式为Fe8O11的化合物,它可以看作由FeO和Fe2O3组成的复杂氧化物.该化合物可以表示为( )
| A. | FeO•3Fe2O3 | B. | 2FeO•3Fe2O3 | C. | FeO•2Fe2O3 | D. | 2FeO•Fe2O3 |
6.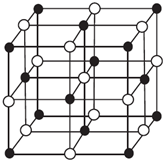 现有前四周期A、B、C、D、E、X六种元素,已知B、C、D、E、A五种非金属元素原子半径依次减小,其中B的s能级上电子总数等于p能级上电子总数的2倍.X原子的M能层上有4个未成对电子.请回答下列问题:
现有前四周期A、B、C、D、E、X六种元素,已知B、C、D、E、A五种非金属元素原子半径依次减小,其中B的s能级上电子总数等于p能级上电子总数的2倍.X原子的M能层上有4个未成对电子.请回答下列问题:
(1)写出C、D、E三种原子第一电离能由大到小的顺序为F>N>O.(用元素符号表示)
(2)A原子与B、C、D原子形成最简单化合物的稳定性由强到弱的顺序为H2O>NH3>CH4(用分子式表示),根据价层电子对互斥理论预测BA2D的分子构型为平面三角形.
(3)某蓝色晶体,其结构特点是X2+、X3+离子分别占据六面体互不相邻的顶点,而六面体的每条棱上均有一个BC-.与A同族且相隔两个周期的元素R的离子位于立方体的恰当位置上.根据其结构特点可知该晶体的化学式为(用最简正整数表示)KFe2(CN)6.
(4)科学家通过X射线探明,KCl、MgO、CaO、TiN的晶体结构与NaCl的晶体结构相似(如图所示),其中3种离子晶体的晶格能数据如下表:
根据表格中的数据:判断KCl、MgO、TiN 三种离子晶体熔点从高到低的顺序是TiN>MgO>KCl.MgO晶体中一个Mg2+周围和它最邻近且等距离的O2-有6个.
(5)研究物质磁性表明:金属阳离子含未成对电子越多,则磁性越大,磁记录性能越好.离子型氧化物V2O5和Cr2O3中,适合作录音带磁粉原料的是Cr2O3.
 现有前四周期A、B、C、D、E、X六种元素,已知B、C、D、E、A五种非金属元素原子半径依次减小,其中B的s能级上电子总数等于p能级上电子总数的2倍.X原子的M能层上有4个未成对电子.请回答下列问题:
现有前四周期A、B、C、D、E、X六种元素,已知B、C、D、E、A五种非金属元素原子半径依次减小,其中B的s能级上电子总数等于p能级上电子总数的2倍.X原子的M能层上有4个未成对电子.请回答下列问题:(1)写出C、D、E三种原子第一电离能由大到小的顺序为F>N>O.(用元素符号表示)
(2)A原子与B、C、D原子形成最简单化合物的稳定性由强到弱的顺序为H2O>NH3>CH4(用分子式表示),根据价层电子对互斥理论预测BA2D的分子构型为平面三角形.
(3)某蓝色晶体,其结构特点是X2+、X3+离子分别占据六面体互不相邻的顶点,而六面体的每条棱上均有一个BC-.与A同族且相隔两个周期的元素R的离子位于立方体的恰当位置上.根据其结构特点可知该晶体的化学式为(用最简正整数表示)KFe2(CN)6.
(4)科学家通过X射线探明,KCl、MgO、CaO、TiN的晶体结构与NaCl的晶体结构相似(如图所示),其中3种离子晶体的晶格能数据如下表:
| 离子晶体 | NaCl | KCl | CaO |
| 晶格能/kJ•mol-1 | 786 | 715 | 3401 |
(5)研究物质磁性表明:金属阳离子含未成对电子越多,则磁性越大,磁记录性能越好.离子型氧化物V2O5和Cr2O3中,适合作录音带磁粉原料的是Cr2O3.
3.设NA为阿伏加德罗常数的数值,下列叙述正确的是( )
| A. | 1mol•L-1MgCl2溶液中的Mg2+数为NA | |
| B. | 1molNa2O2固体中含阴离子总数为2NA | |
| C. | 5g质量分数为46%的乙醇溶液中,氢原子的总数为0.6NA | |
| D. | 100mL12mol•L-1浓盐酸与足量MnO2加热反应,转移电子数为1.2NA |
