题目内容
14.德国科学家最近研究证实,单一不饱和脂肪酸可有效降低低密度脂蛋白胆固醇含量.在摄入足够的这种脂肪酸的前提下,适当进食脂肪并不会对人体内的胆固醇含量产生不良影响.花生四烯酸(Arachidonicacid,简称AA)即5,8,11,14-二十碳烯酸,其分子式可表示为C19H31COOH,它是人体中最重要的一种多不饱和脂肪酸(PUPA),是人体“必需脂肪酸”之一.以下关于它的说法中不正确的是( )| A. | 每摩尔花生四烯酸最多可与4 mol溴发生加成反应 | |
| B. | 它可以使酸性高锰酸钾溶液褪色 | |
| C. | 它可与乙醇发生酯化反应 | |
| D. | 它是食醋的主要成分 |
分析 A.发生加成反应时,碳碳双键个数的物质的量与溴的物质的量相等;
B.碳碳双键不稳定,易被强氧化剂氧化;
C.羧酸和醇在一定条件下能发生酯化反应;
D.食醋的主要成分是乙酸.
解答 解:A.发生加成反应时,碳碳双键个数的物质的量与溴的物质的量相等,花生四烯酸分子中含有4个碳碳双键,所以每摩尔花生四烯酸最多可与4mol溴发生加成反应,故A正确;
B.碳碳双键不稳定,易被强氧化剂酸性高锰酸钾氧化生成羧酸,故B正确;
C.羧酸和醇在一定条件下能发生酯化反应,花生四烯酸中含有羧基,所以能和乙醇发生酯化反应,故C正确;
D.食醋的主要成分是乙酸,所以花生四烯酸不是食醋的主要成分,故D错误;
故选D.
点评 本题考查有机物的结构和性质,明确有机物中存在的官能团是解本题关键,熟练掌握烯烃、醇、酚、醛、羧酸的性质,题目难度不大.

练习册系列答案
相关题目
4.可以用来鉴别甲烷和乙烯,又可以用来除去甲烷中混有的少量乙烯的操作方法为( )
| A. | 混合气体通过盛有酸性高锰酸钾溶液的洗气瓶 | |
| B. | 混合气体通过盛有足量溴水的洗气瓶 | |
| C. | 混合气体通过盛有蒸馏水的洗气瓶 | |
| D. | 混合气体通过盛有NaOH溶液的洗气瓶 |
5.“塑料袋--想说爱你不容易!”自1902年10月24 奥地利科学家马克斯•舒施尼发明它以来,也只有短短的一百多年时间.这些花花绿绿、大大小小的塑料袋,不仅破坏城市景观,对环境的危害也是极惊人的.2008年6月1日起,根据国务院要求,所有超市、商场、集贸市场等商品零售场所实行塑料购物袋有偿使用.下列说法正确的是( )
| A. | 聚丙烯塑料的结构简式为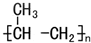 | |
| B. | 聚氯乙烯塑料单体的电子式为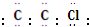 | |
| C. | 塑料购物袋的生产原料需要消耗大量木材 | |
| D. | 聚乙烯中含碳质量分数与其单体的含碳质量分数相同 |
2.一定条件下,可逆反应N2+3H2═2NH3△H<0 达到平衡后,只改变一个条件,下列叙述错误的是( )
| A. | 加催化剂,v正、v逆 都发生变化,且变化的倍数相等 | |
| B. | 加压,v正、v逆 都增大,且v正 增大的倍数大于V逆增大的倍数 | |
| C. | 增大氮气的浓度,N2的平衡转化率减小,H2的平衡转化率增大 | |
| D. | 降温,v正、v逆 都减小,且v正 减小的倍数大于v逆减小的倍数 |
9.铁的常见化合价有+2和+3.据研究,铁在浓HNO3中发生钝化时,可生成一种化学式为Fe8O11的化合物,它可以看作由FeO和Fe2O3组成的复杂氧化物.该化合物可以表示为( )
| A. | FeO•3Fe2O3 | B. | 2FeO•3Fe2O3 | C. | FeO•2Fe2O3 | D. | 2FeO•Fe2O3 |
6.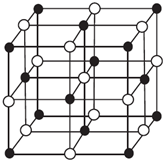 现有前四周期A、B、C、D、E、X六种元素,已知B、C、D、E、A五种非金属元素原子半径依次减小,其中B的s能级上电子总数等于p能级上电子总数的2倍.X原子的M能层上有4个未成对电子.请回答下列问题:
现有前四周期A、B、C、D、E、X六种元素,已知B、C、D、E、A五种非金属元素原子半径依次减小,其中B的s能级上电子总数等于p能级上电子总数的2倍.X原子的M能层上有4个未成对电子.请回答下列问题:
(1)写出C、D、E三种原子第一电离能由大到小的顺序为F>N>O.(用元素符号表示)
(2)A原子与B、C、D原子形成最简单化合物的稳定性由强到弱的顺序为H2O>NH3>CH4(用分子式表示),根据价层电子对互斥理论预测BA2D的分子构型为平面三角形.
(3)某蓝色晶体,其结构特点是X2+、X3+离子分别占据六面体互不相邻的顶点,而六面体的每条棱上均有一个BC-.与A同族且相隔两个周期的元素R的离子位于立方体的恰当位置上.根据其结构特点可知该晶体的化学式为(用最简正整数表示)KFe2(CN)6.
(4)科学家通过X射线探明,KCl、MgO、CaO、TiN的晶体结构与NaCl的晶体结构相似(如图所示),其中3种离子晶体的晶格能数据如下表:
根据表格中的数据:判断KCl、MgO、TiN 三种离子晶体熔点从高到低的顺序是TiN>MgO>KCl.MgO晶体中一个Mg2+周围和它最邻近且等距离的O2-有6个.
(5)研究物质磁性表明:金属阳离子含未成对电子越多,则磁性越大,磁记录性能越好.离子型氧化物V2O5和Cr2O3中,适合作录音带磁粉原料的是Cr2O3.
 现有前四周期A、B、C、D、E、X六种元素,已知B、C、D、E、A五种非金属元素原子半径依次减小,其中B的s能级上电子总数等于p能级上电子总数的2倍.X原子的M能层上有4个未成对电子.请回答下列问题:
现有前四周期A、B、C、D、E、X六种元素,已知B、C、D、E、A五种非金属元素原子半径依次减小,其中B的s能级上电子总数等于p能级上电子总数的2倍.X原子的M能层上有4个未成对电子.请回答下列问题:(1)写出C、D、E三种原子第一电离能由大到小的顺序为F>N>O.(用元素符号表示)
(2)A原子与B、C、D原子形成最简单化合物的稳定性由强到弱的顺序为H2O>NH3>CH4(用分子式表示),根据价层电子对互斥理论预测BA2D的分子构型为平面三角形.
(3)某蓝色晶体,其结构特点是X2+、X3+离子分别占据六面体互不相邻的顶点,而六面体的每条棱上均有一个BC-.与A同族且相隔两个周期的元素R的离子位于立方体的恰当位置上.根据其结构特点可知该晶体的化学式为(用最简正整数表示)KFe2(CN)6.
(4)科学家通过X射线探明,KCl、MgO、CaO、TiN的晶体结构与NaCl的晶体结构相似(如图所示),其中3种离子晶体的晶格能数据如下表:
| 离子晶体 | NaCl | KCl | CaO |
| 晶格能/kJ•mol-1 | 786 | 715 | 3401 |
(5)研究物质磁性表明:金属阳离子含未成对电子越多,则磁性越大,磁记录性能越好.离子型氧化物V2O5和Cr2O3中,适合作录音带磁粉原料的是Cr2O3.
3.Na、Cu、C、P、Cl是常见的五种元素.
(1)P原子的最外层电子数为5.
(2)用“>”或“<”填空:
(3)CuCl与O2反应生成CuCl2和一种黑色固体,该反应的化学方程式是4CuCl+O2=2CuCl2+2CuO.
(4)P的最高价氧化物对应的水化物与Na的最高价氧化物对应的水化物反应最多能生成3种盐.
(5)Cl2O为国际公认的高效安全灭菌消毒剂之一,工业上可用Cl2通入Na2CO3溶液制取,同时生成一种食品中的膨松剂,写出该反应的离子方程式2Cl2+2CO32-+H2O=2HCO3-+2Cl-+Cl2O.
(1)P原子的最外层电子数为5.
(2)用“>”或“<”填空:
| 离子半径 | 熔点 | 酸性 |
| Cl- >Na+ | NaCl <C(金刚石) | H3PO4 <HClO4 |
(4)P的最高价氧化物对应的水化物与Na的最高价氧化物对应的水化物反应最多能生成3种盐.
(5)Cl2O为国际公认的高效安全灭菌消毒剂之一,工业上可用Cl2通入Na2CO3溶液制取,同时生成一种食品中的膨松剂,写出该反应的离子方程式2Cl2+2CO32-+H2O=2HCO3-+2Cl-+Cl2O.
20.n g CO2中有m个O原子,则阿伏加德罗常数NA的数值可表示为( )
| A. | 22m/n mol-1 | B. | m/22n mol-1 | C. | n/32m mol-1 | D. | n/32mmol-1 |