题目内容
20.下列物质不属于合金的是( )| A. | 金刚石 | B. | 硬铝 | C. | 不锈钢 | D. | 青铜 |
分析 合金是指在一种金属中加热熔合其它金属或非金属而形成的具有金属特性的物质;合金具有以下特点:①一定是混合物;②合金中至少有一种金属等,据此分析解答.
解答 解:A.合金属于混合物,金刚石由碳元素一种元素组成的非金属单质,不属于合金,故A选;
B.硬铝是指以铝为主要合金元素的一类铝合金,故B不选;
C.不锈钢是铁与少量的碳元素所组成的合金,故C不选;
D.青铜是铜锡合金或铜铅合金,故D不选;
故选A.
点评 本题主要考查合金的判别,掌握合金的特征是正确解答本题的关键.题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
10.如图是实验室制备氯气并验证氯气性质的装置(其中夹持装置已省略)
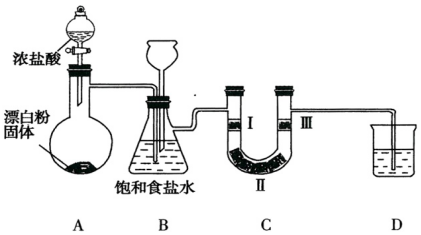
已知:装置A是氯气的发生装置,反应的化学方程式为:
Ca(ClO)2+4HCl(浓)═CaCl2+2Cl2↑+2H2O.
据此回答下列问题:
(1)装置B中饱和食盐水的作用是除去Cl2中的HCl.
(2)装置B也是安全瓶,目的是监测实验进行时装置C中是否发生堵塞,请写出装置C中发生堵塞时装置B中的实验现象:B中长颈漏斗中液面上升.
(3)装置C的目的是验证氯气是否具有漂白性,则装置C中Ⅰ、Ⅱ、Ⅲ处依次应放入的物质是d(填序号).
(4)装置D的作用是吸收多余的氯气,防止污染空气,则烧杯中的溶液是NaOH溶液,写出所发生反应的化学方程式:Cl2+2NaOH=NaCl+NaClO+H2O.
(5)若所用浓盐酸的浓度为10mol/L,求产生2.24L(标准状况)Cl2时,发生反应的盐酸为40mL.

已知:装置A是氯气的发生装置,反应的化学方程式为:
Ca(ClO)2+4HCl(浓)═CaCl2+2Cl2↑+2H2O.
据此回答下列问题:
(1)装置B中饱和食盐水的作用是除去Cl2中的HCl.
(2)装置B也是安全瓶,目的是监测实验进行时装置C中是否发生堵塞,请写出装置C中发生堵塞时装置B中的实验现象:B中长颈漏斗中液面上升.
(3)装置C的目的是验证氯气是否具有漂白性,则装置C中Ⅰ、Ⅱ、Ⅲ处依次应放入的物质是d(填序号).
| 编号 | I | II | III |
| a | 干燥的有色布条 | 碱石灰 | 湿润的有色布条 |
| b | 干燥的有色布条 | 无水硫酸铜 | 湿润的有色布条 |
| c | 湿润的有色布条 | 浓硫酸 | 干燥的有色布条 |
| d | 湿润的有色布条 | 无水氯化钙 | 干燥的有色布条 |
(5)若所用浓盐酸的浓度为10mol/L,求产生2.24L(标准状况)Cl2时,发生反应的盐酸为40mL.
15.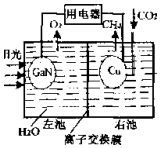 太阳能光电池由于具有可靠性好、寿命长等特点,适于很多特蛛环境和场合,现已得到广泛应用.氮化镓(GaN)光电池的结构如图所示.下列说法中正确的是( )
太阳能光电池由于具有可靠性好、寿命长等特点,适于很多特蛛环境和场合,现已得到广泛应用.氮化镓(GaN)光电池的结构如图所示.下列说法中正确的是( )
 太阳能光电池由于具有可靠性好、寿命长等特点,适于很多特蛛环境和场合,现已得到广泛应用.氮化镓(GaN)光电池的结构如图所示.下列说法中正确的是( )
太阳能光电池由于具有可靠性好、寿命长等特点,适于很多特蛛环境和场合,现已得到广泛应用.氮化镓(GaN)光电池的结构如图所示.下列说法中正确的是( )| A. | 该装置系统中只存在两种能量转化 | |
| B. | Cu电极上的电极反应为:CO2+8e-+8H+═CH4+2H2O | |
| C. | 离子交换膜为质子交换膜,H+从右池移向左池 | |
| D. | 常温下,当装置中有1mol CH4生成时,GaN电极有 44.8LO2生成(不考虑O2的溶解性) |
5.实验室除去硝基苯中的氮氧化物杂质时用不到的仪器是( )
| A. | 漏斗 | B. | 分液漏斗 | C. | 烧杯 | D. | 铁架台 |
12.不能用单质直接反应得到的是( )
| A. | NaCl | B. | MgCl2 | C. | AlC13 | D. | FcC12 |
9.设NA为阿伏伽德罗常数的值,下列说法正确的是( )
| A. | 标准状况下,11.2L甲醇中含有的分子数为0.5NA | |
| B. | 4.4gN2O和CO2的混合气体中含有的原子数为0.3NA | |
| C. | 4.2g乙烯和丙烯混合气体中含有的共价键数为0.6NA | |
| D. | 25°C时,1.0L,PH=13 的 Ba(OH)2 溶液中含有的OH-数为0.2NA |
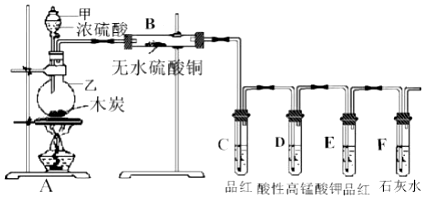
 C、N、O、Na、Al、Si、S、Cl是常见的八种元素
C、N、O、Na、Al、Si、S、Cl是常见的八种元素 .
.