题目内容
7.用NA表示阿伏加德罗常数,下列叙述正确的是( )| A. | 标准状况下,22.4LH2SO4含有的原子数为7NA | |
| B. | 16g氧气和16g臭氧含有的氧原子数均为NA | |
| C. | 常温常压下,14gN2含有电子数为14NA | |
| D. | 28gCO与22.4LCO2所含的碳原子数相等 |
分析 A、标况下硫酸为液体;
B、氧气和臭氧均由氧原子构成;
C、求出氮气的物质的量,然后根据1mol氮气中含14mol电子来分析;
D、二氧化碳所处的状态不明确.
解答 解:A、标况下硫酸为液体,故不能根据气体摩尔体积来计算其物质的量和含有的原子个数,故A错误;
B、氧气和臭氧均由氧原子构成,故16g氧气和16g臭氧中含有的氧原子的物质的量均为n=$\frac{16g}{16g/mol}$=1mol,个数为NA个,故B正确;
C、14g氮气的物质的量n=$\frac{14g}{28g/mol}$=0.5mol,而1mol氮气中含14mol电子,故0.5mol氮气中含7mol电子即7NA个,故C错误;
D、二氧化碳所处的状态不明确,故二氧化碳的物质的量和含有的碳原子数无法计算,故D错误.
故选B.
点评 本题考查了阿伏伽德罗常数的有关计算,掌握物质的量的计算公式和物质结构是解题关键,难度不大.

练习册系列答案
相关题目
17.将下列各组物质按酸、碱、盐分类顺序排列正确的是( )
| A. | 硫酸 纯碱 硫酸钠 | B. | 氢溴酸 烧碱 绿矾 | ||
| C. | 碳酸 乙酸 醋酸钠 | D. | 磷酸 熟石灰 苛性钠 |
18.某科学家利用二氧化铈(CeO2)在太阳能作用下将H2O、CO2转变成H2、CO.其过程如图:下列说法不正确的是( )


| A. | 该过程中CeO2做催化剂 | |
| B. | 该过程实现了太阳能与化学能的相互转化 | |
| C. | 图中△H1+△H2+△H3﹦0 | |
| D. | 以CO和O2构成的碱性燃料电池的负极反应式为:CO+4OH--2e-═CO32-+2H2O |
15.下列关于氯及其化合物的说法正确的是( )
| A. | 氯气和液氯是两种不同的物质 | |
| B. | Cl2通入到含有酚酞的NaOH溶液中红色褪去,因为氯气有漂白性 | |
| C. | Cl2在化学反应中既能作氧化剂,又能作还原剂 | |
| D. | 新制的氯水呈酸性,向其中滴加几滴紫色石蕊试液并振荡,溶液呈红色 |
2.下列物质的体积约为22.4L的是( )
| A. | 标准状况下1molH2O | |
| B. | 20℃、101kPa时36.5gHCl | |
| C. | 常温常压下17gNH3 | |
| D. | 标准状况下0.4mol H2和0.6molO2的混合气 |
12.向盛有100mLNH4Al(SO4)2溶液的烧杯中滴加NaOH溶液,沉淀物质的量随NaOH溶液体积变化示意图如下:
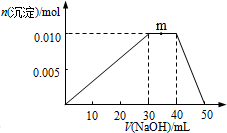
下列说法正确的是( )

下列说法正确的是( )
| A. | NH4Al(SO4)2的电离方程式为:NH4Al(SO4)2?NH4++Al3++2SO42- | |
| B. | m点反应的离子方程式:NH4++OH-═NH3•H2O | |
| C. | 反应过程中SO42-的浓度始终保持不变 | |
| D. | 由图象可知所滴NaOH溶液的浓度为0.1mol•L-1 |
19.下列说法正确的是( )
| A. | 在NaHCO3溶液中一定有c(Na+)+c(H+)=c(HCO3-)+c(OH-)+2c(CO32-) | |
| B. | 在等体积、等物质的量浓度的Na2CO3和NaHCO3两溶液中,阳离子总数相等 | |
| C. | 在Na2CO3和NaHCO3两溶液中,离子种类不相同 | |
| D. | 在NaHCO3溶液中一定有c(Na+)>c(CO32-)>c(H+)>c(OH-) |
1. 将洁净的三种金属片X、Y和Z分别放置在浸有食盐溶液的滤纸上并压紧(如图).每次实验时,电压表指针的偏移方向和读数如下表.已知构成两电极的金属,活泼性相差越大,则电压越大.对X、Y、Z和铜四种金属的下列说法,不正确的是( )
将洁净的三种金属片X、Y和Z分别放置在浸有食盐溶液的滤纸上并压紧(如图).每次实验时,电压表指针的偏移方向和读数如下表.已知构成两电极的金属,活泼性相差越大,则电压越大.对X、Y、Z和铜四种金属的下列说法,不正确的是( )
 将洁净的三种金属片X、Y和Z分别放置在浸有食盐溶液的滤纸上并压紧(如图).每次实验时,电压表指针的偏移方向和读数如下表.已知构成两电极的金属,活泼性相差越大,则电压越大.对X、Y、Z和铜四种金属的下列说法,不正确的是( )
将洁净的三种金属片X、Y和Z分别放置在浸有食盐溶液的滤纸上并压紧(如图).每次实验时,电压表指针的偏移方向和读数如下表.已知构成两电极的金属,活泼性相差越大,则电压越大.对X、Y、Z和铜四种金属的下列说法,不正确的是( )| 金属片 | 电子流向 | 电压(V) |
| X | X→Cu | +0.78 |
| Y | Cu→Y | -0.15 |
| Z | Z→Cu | +1.35 |
| A. | Z金属可作为牺牲阳极保护法的阳极,保护Y金属 | |
| B. | Y金属不能从硫酸溶液中置换出氢气 | |
| C. | 三种金属的活泼性顺序为:Y>X>Z | |
| D. | Z和Y能构成电压最大的原电池 |
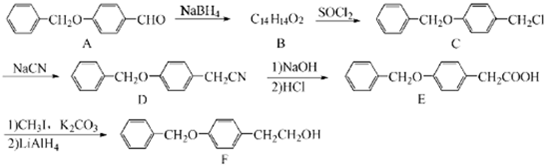
 ;由C→D的反应类型是:取代反应.
;由C→D的反应类型是:取代反应.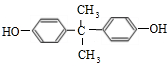
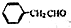 为原料制备
为原料制备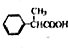 的合成路线示意图(无机试剂任用).合成路线示意图例如题干.
的合成路线示意图(无机试剂任用).合成路线示意图例如题干.