题目内容
短周期元素W、X、Y和Z的原子序数依次增大.其中W的原子半径最小,X的一种核素在考古时常用来鉴定一些文物的年代,工业上采用液态空气分馏方法来生产Y的单质,且Y和Z可以形成化合物ZY2和ZY3.根据以上叙述,下列说法中正确的是( )
| A、以上四种元素的原子半径大小为W<X<Y<Z |
| B、W、X、Y、Z原子的核外最外层电子数的总和为20 |
| C、W与Y可形成既含极性共价键又含非极性共价键的化合物 |
| D、由W与X组成的化合物的沸点总低于由W与Y组成的化合物的沸点 |
考点:位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题
分析:X的一种核素在考古时常用来鉴定一些文物的年代,用的是14C,采用的是断代法,则X为C元素;
工业上采用液态空气分馏方法来生产Y的单质,因此Y可能是氧气或氮气;又因为Y和Z可以形成化合物ZY2和ZY3,且短周期元素W、X、Y和Z的原子序数依次增大,所以Y是氧元素,Z是硫元素;W的原子半径最小,所以W是H元素,
根据分析可知:W为H元素、X为C元素、Y为O元素、Z为S元素.
工业上采用液态空气分馏方法来生产Y的单质,因此Y可能是氧气或氮气;又因为Y和Z可以形成化合物ZY2和ZY3,且短周期元素W、X、Y和Z的原子序数依次增大,所以Y是氧元素,Z是硫元素;W的原子半径最小,所以W是H元素,
根据分析可知:W为H元素、X为C元素、Y为O元素、Z为S元素.
解答:
解:X的一种核素在考古时常用来鉴定一些文物的年代,用的是14C,采用的是断代法,则X为C元素;工业上采用液态空气分馏方法来生产Y的单质,因此Y可能是氧气或氮气;又因为Y和Z可以形成化合物ZY2和ZY3,且短周期元素W、X、Y和Z的原子序数依次增大,所以Y是氧元素,Z是硫元素;W的原子半径最小,所以W是H元素,
A.同周期元素从左到右元素的原子半径逐渐减小,同主族元素自上而下原子半径逐渐增大,所以四种元素的原子半径大小为:H<O<C<S,即:W<Y<X<Z,故A错误;
B.W、X、Y、Z原子的核外最外层电子数的总和为:1+4+8+8=21,故B错误;
C.W为H元素、Y为O元素,W与Y可形成化合物H2O2中,既含极性共价键H-O键,又含非极性共价键O-O键,故C正确;
D.W为H元素,X为C元素,Y为N元素,C元素与H元素可以形成多种烃类化合物,当相对分子质量较大时,形成的烃在常温下为液体或固体,沸点较高,可以高于氧元素与氢元素形成的化合物的沸点,D错误;
故选C.
A.同周期元素从左到右元素的原子半径逐渐减小,同主族元素自上而下原子半径逐渐增大,所以四种元素的原子半径大小为:H<O<C<S,即:W<Y<X<Z,故A错误;
B.W、X、Y、Z原子的核外最外层电子数的总和为:1+4+8+8=21,故B错误;
C.W为H元素、Y为O元素,W与Y可形成化合物H2O2中,既含极性共价键H-O键,又含非极性共价键O-O键,故C正确;
D.W为H元素,X为C元素,Y为N元素,C元素与H元素可以形成多种烃类化合物,当相对分子质量较大时,形成的烃在常温下为液体或固体,沸点较高,可以高于氧元素与氢元素形成的化合物的沸点,D错误;
故选C.
点评:本题考查了位置、结构与性质的关系,题目难度中等,正确推断元素的种类为解答该题的关键,注意掌握原子结构与元素周期表、元素周期表的关系,易错点为D,需要明确碳氢化合物的种类以及性质.

练习册系列答案
相关题目
下列说法正确的是( )
| A、常温下醋酸分子不可能存在于pH>7的碱性溶液中 |
| B、在0.lmol/L Na2SO3的溶液中加入少量NaOH固体,c(Na+)增大,c(SO32-)减小 |
| C、0.lmoI.L-lNH4Cl溶液与0.05moI.L-l NaOH溶液等体积混合溶液中离子浓度:c (Cl-)>c (NH4+)>c (Na+)>c (OH-) |
| D、a mol/L HCN溶液与6 mol/L NaOH溶液等体积混合,所得溶液中c (Na+)>c (CN-),则a一定小于6 |
下列说法正确的是( )
| A、原电池反应是自发的氧化还原反应,盐桥的作用是平衡正负极电荷,形成闭合回路 |
| B、为防止轮船发生腐蚀,往往在轮船外壳焊上金属锌,这是牺牲阴极的阳极保护法 |
| C、精炼铜时,粗铜做阳极,纯铜做阴极,CuSO4是电解质溶液,电解前后溶液浓度不变 |
| D、电镀是特殊的电解,电解前后阴极减少的质量与阳极增加的质量相等 |
 ”表示上述相关元素的原子中除去最外层电子的剩余部分,“
”表示上述相关元素的原子中除去最外层电子的剩余部分,“ ”表示没有形成共价键的最外层电子,短线表示共价键.
”表示没有形成共价键的最外层电子,短线表示共价键.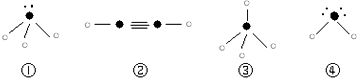
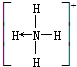 (→表示共用电子对由N原子单方面提供). 请画出N4H44+的结构式
(→表示共用电子对由N原子单方面提供). 请画出N4H44+的结构式