题目内容
X、Y、Z三种元素的原子,其最外层电子排布为ns1,3s23p1和2s22p4,由这三种元素组成的化合物的化学式可能是( )
| A、X2YZ3 |
| B、X2YZ2 |
| C、X3YZ3 |
| D、XYZ3 |
考点:原子结构与元素的性质
专题:原子组成与结构专题
分析:X原子最外层电子排布为ns1,处于第ⅠA族,化合价为+1,Y原子最外层电子排布为3s23p1,则Y为Al元素,Z原子最外层电子排布为2s22p4,则Z为氧元素,化合价为-2,结合化合价规则与常见物质化学式进行判断.
解答:
解:X原子最外层电子排布为ns1,处于第ⅠA族,化合价为+1,Y原子最外层电子排布为3s23p1,则Y为Al元素,Z原子最外层电子排布为2s22p4,则Z为氧元素,化合价为-2,
A.X2YZ3中Y的化合价为+4价,不符合,故A错误;
B.X2YZ2中Y的化合价为+2价,不符合,故B错误;
C.X3YZ3中Y的化合价为+3价,符合,故C正确;
D.XYZ3中Y的化合价为+5价,不符合,故D错误;
故选C.
A.X2YZ3中Y的化合价为+4价,不符合,故A错误;
B.X2YZ2中Y的化合价为+2价,不符合,故B错误;
C.X3YZ3中Y的化合价为+3价,符合,故C正确;
D.XYZ3中Y的化合价为+5价,不符合,故D错误;
故选C.
点评:本题考查原子核外电子排布、原子结构与性质,关键是推断元素种类,再利用化合价规则解答,题目难度不大.

练习册系列答案
相关题目
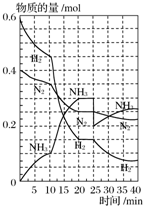 500℃、20MPa时,将H2和N2置于一容积为2L的密闭容器中发生反应.反应过程中H2、N2和NH3的物质的量变化如图所示,下列说法中正确的是( )
500℃、20MPa时,将H2和N2置于一容积为2L的密闭容器中发生反应.反应过程中H2、N2和NH3的物质的量变化如图所示,下列说法中正确的是( )| A、从反应开始到第一次平衡时,N2的平均反应速率为0.005 mol?L-1?min-1 |
| B、平衡在10 min至20 min的变化,可能是因为增大了容器体积 |
| C、25 min时,分离出了0.1 mol NH3 |
| D、在25 min后平衡向正反应方向移动,新平衡中NH3的体积分数比原平衡的小 |
有Fe2+、NO3-、Fe3+、NH4+、H+和H2O六种微粒,分别属于一个氧化还原反应中的反应物和生成物,下列叙述错误的是( )
| A、若有l mol NO3-参加还原反应,则转移8mol e- |
| B、还原产物为NH4+ |
| C、氧化剂与还原剂的物质的量之比为8:l |
| D、若把该反应设计为原电池,则负极反应为Fe 2+-e-=Fe 3+ |
下列溶液中,Na+数目最多的是( )
| A、1 mol?L-1 Na2SO4溶液100mL |
| B、0.9 mol?L-1Na3PO4溶液100mL |
| C、2.5 mol?L-1NaOH 溶液100mL |
| D、1 mol?L-1 NaHCO3溶液100mL |
下列说法正确的是( )
| A、常温下醋酸分子不可能存在于pH>7的碱性溶液中 |
| B、在0.lmol/L Na2SO3的溶液中加入少量NaOH固体,c(Na+)增大,c(SO32-)减小 |
| C、0.lmoI.L-lNH4Cl溶液与0.05moI.L-l NaOH溶液等体积混合溶液中离子浓度:c (Cl-)>c (NH4+)>c (Na+)>c (OH-) |
| D、a mol/L HCN溶液与6 mol/L NaOH溶液等体积混合,所得溶液中c (Na+)>c (CN-),则a一定小于6 |
 密闭容器中发生如下反应:A(g)+3B(g)?2C(g)△H<0,根据下列速率-时间图象,回答下列问题.
密闭容器中发生如下反应:A(g)+3B(g)?2C(g)△H<0,根据下列速率-时间图象,回答下列问题.