题目内容
 A、B、C、D、E是周期表中原子序数依次增大的前20号主族元素,其中A、D同族. A是周期表中电负性最大的元素,金属元素B、C最高价氧化物对应的水化物能反应生成盐和水,E元素以骨盐形式存在于骨骼和牙齿中.根据信息,回答下列问题:
A、B、C、D、E是周期表中原子序数依次增大的前20号主族元素,其中A、D同族. A是周期表中电负性最大的元素,金属元素B、C最高价氧化物对应的水化物能反应生成盐和水,E元素以骨盐形式存在于骨骼和牙齿中.根据信息,回答下列问题:(1)与E同周期且原子序数相差4的元素原子的价层电子排布式为
(2)C单质、镁、B的最高价氧化物对应水化物可以构成原电池,则负极的电极反应式为
(3)A和D的氢化物中,沸点较高的是
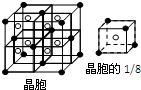
(4)A和E可组成离子化合物,其晶胞结构如图所示,其中“●”表示的是
已知该化合物晶胞1/8的体积为2.0×10-23cm3,求A和E组成的离子化合物的密度,请列式并计算(结果保留一位小数):
考点:晶胞的计算,位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题
分析:A是周期表中电负性最大的元素,应为F,A、D同族,则D为Cl元素,金属元素B、C最高价氧化物对应的水化物能反应生成盐和水,B应为Na,C为Al,形成的化合物为NaAlO2,E元素以骨盐形式存在于骨骼和牙齿中,应为Ca元素,以此解答该题.
解答:
解:A是周期表中电负性最大的元素,应为F,A、D同族,则D为Cl元素,金属元素B、C最高价氧化物对应的水化物能反应生成盐和水,B应为Na,C为Al,形成的化合物为NaAlO2,E元素以骨盐形式存在于骨骼和牙齿中,应为Ca元素,
(1)与E同周期且原子序数相差4的元素原子的原子序数为24,应为Cr元素,价层电子排布式为3d54s1,故答案为:3d54s1;
(2)Al单质、镁、Na的最高价氧化物对应水化物可以构成原电池,因铝可与氢氧化钠溶液反应,则铝为负极,电极方程式为Al-3e-+4OH-=AlO2-+2H2O,
故答案为:Al-3e-+4OH-=AlO2-+2H2O;
(3)HF含有氢键,沸点较高,Al3+、Na+、F-具有相同的核外电子排布,核电荷数越大,离子半径越小,则Al3+<Na+<F-,核外有3个电子层,Cl-离子半径最大,所以顺序为Al3+<Na+<F-<Cl-,
故答案为:HF; Al3+<Na+<F-<Cl-;
(4)F和Ca可组成离子化合物,由晶胞可知“●”的个数为4×
=
,而“○”位于体心,为1个,则“●”与“○”的比值为1:2,化学式为CaF2,“●”应为Ca2+,该化合物的电子式是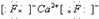 ,ρ=
,ρ=
=
=
=3.2 g/cm3,
故答案为:Ca2+;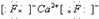 ;
;
=3.2 g/cm3.
(1)与E同周期且原子序数相差4的元素原子的原子序数为24,应为Cr元素,价层电子排布式为3d54s1,故答案为:3d54s1;
(2)Al单质、镁、Na的最高价氧化物对应水化物可以构成原电池,因铝可与氢氧化钠溶液反应,则铝为负极,电极方程式为Al-3e-+4OH-=AlO2-+2H2O,
故答案为:Al-3e-+4OH-=AlO2-+2H2O;
(3)HF含有氢键,沸点较高,Al3+、Na+、F-具有相同的核外电子排布,核电荷数越大,离子半径越小,则Al3+<Na+<F-,核外有3个电子层,Cl-离子半径最大,所以顺序为Al3+<Na+<F-<Cl-,
故答案为:HF; Al3+<Na+<F-<Cl-;
(4)F和Ca可组成离子化合物,由晶胞可知“●”的个数为4×
| 1 |
| 8 |
| 1 |
| 2 |
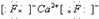 ,ρ=
,ρ=| m |
| V |
| ||||
| 2×10-23cm3 |
| (40+19×2)g/mol |
| 2×2×10-23cm3×6.02×1023mol-1 |
故答案为:Ca2+;
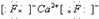 ;
;| (40+19×2)g/mol |
| 2×2×10-23cm3×6.02×1023mol-1 |
点评:本题考查了元素位置结构性质的相互关系及应用,为高频考点,涉及元素推断、晶体的计算、元素周期律等知识点,根据原子结构、物质性质确定元素,再结合均摊法、元素周期律等知识点来分析解答,题目难度不大.

练习册系列答案
 通城学典默写能手系列答案
通城学典默写能手系列答案
相关题目
下列说法正确的是( )
| A、电解质在水中一定能导电 |
| B、纯水的导电性很差,所以水不是电解质 |
| C、溶液导电性的强弱取决于溶液中离子浓度及所带电荷的多少 |
| D、NaCl溶液在电流作用下电离成Na+与Cl- |
下列说法正确的是( )
| A、常温下醋酸分子不可能存在于pH>7的碱性溶液中 |
| B、在0.lmol/L Na2SO3的溶液中加入少量NaOH固体,c(Na+)增大,c(SO32-)减小 |
| C、0.lmoI.L-lNH4Cl溶液与0.05moI.L-l NaOH溶液等体积混合溶液中离子浓度:c (Cl-)>c (NH4+)>c (Na+)>c (OH-) |
| D、a mol/L HCN溶液与6 mol/L NaOH溶液等体积混合,所得溶液中c (Na+)>c (CN-),则a一定小于6 |
在实验室里进行分液操作,下列实验仪器中一定需要使用的是( )
| A、容量瓶 | B、分液漏斗 |
| C、玻璃棒 | D、温度计 |