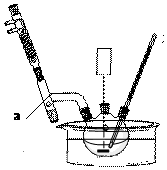
题目内容
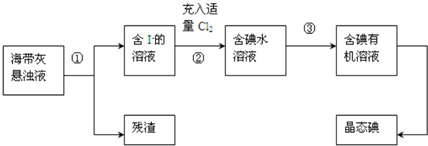
6.海带、海藻中丰富的碘元素主要以碘化钾的形式存在.化学小组欲用海带制取少量碘单质,先将海带烧成灰,再用水浸泡一段时间(让碘化物充分溶解),得到海带灰悬浊液,然后按以下流程提取单质碘(已知:2I-+Cl2=2Cl-+I2).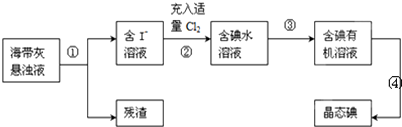
(1)过程①中的实验操作名称是过滤;
(2)过程②中充入适量Cl2的目的是使I-完全转化为I2;
(3)提取碘的过程中实验操作③的名称:萃取 分液,选择的有机试剂可以是BD(填序号).
A.酒精 B.四氯化碳 C.醋酸 D.苯
(4)过程③中有以下操作:
①倒转漏斗用力振荡,并不时旋开活塞放气,最后关闭活塞,放正分液漏斗;
②把50ml碘水和15ml有机溶剂加入分液漏斗中,并盖好玻璃塞;
③将漏斗上口的玻璃塞打开或使塞上的凹槽与漏斗上口的小孔对准;
④把盛有溶液的分液漏斗放在铁架台的铁圈中,静置、分层;
⑤从分液漏斗上口倒出上层液体.
⑥旋开分液漏斗下面的活塞,用烧杯接收下层液体;
⑦检验分液漏斗活塞和上口的玻璃塞是否漏液;
操作顺序正确的是⑦②①④③⑤⑥(填字母).
分析 (1)分离固体与液体混合物应用过滤;
(2)氯气具有强的氧化性,能够将碘离子氧化为单质碘;
(3)碘易溶于有机溶剂,分离两种相互溶解的液体应选择分液操作;从碘水中提取碘操作为萃取,结合萃取剂选择原则解答;
(4)从碘水中萃取碘并用分液漏斗分离两种溶液,操作为查漏→装液→振荡→静置→分液,据此排序.
解答 解:(1)依据流程图可知通过操作①将海带灰悬浊液分离为含碘离子的溶液和残渣,分离固体与液体混合物的 操作为过滤,所以①为过滤;
故答案为:过滤;
(2)氯气具有强的氧化性,能够将碘离子氧化为单质碘,所以过程②中充入适量Cl2的目的是使I-完全转化为I2;
故答案为:使I-完全转化为I2;
(3)碘易溶于有机溶剂,从碘水中提取碘操作为萃取,萃取剂选择原则:①和原溶液中的溶剂互不相溶; ②对溶质的溶解度要远大于原溶剂,酒精、醋酸能够与水相溶,所以不能用来萃取碘,碘易溶于有机溶剂,苯、四氯化碳与水互不相溶,可以用来萃取碘;分离两种相互溶解的液体应选择分液操作;
故答案为:萃取 分液;BD;
(4)CCl4从碘水中萃取碘并用分液漏斗分离两种溶液,操作为查漏→装液→振荡→静置→分液,所以正确的顺序为:⑦②①④③⑤⑥;
故答案为:⑦②①④③⑤⑥.
点评 本题以海水提镁的工艺流程为载体考查混合物分离提纯,为高频考点,把握物质的性质选择分离、提纯的方法为解答的关键,侧重分离原理及分离实验步骤的考查,题目难度中等.

练习册系列答案
相关题目
7.下列对有机化合物的分类结果正确的是( )
| A. | 乙烯、苯、环己烷都属于脂肪烃 | B. | 苯、环戊烷、环己烷同属于芳香烃 | ||
| C. | 乙烯、乙炔同属于烯烃 | D. |  、 、 、 、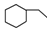 同属于环烷烃 同属于环烷烃 |
8.下列说法正确的是( )
| A. | 增大压强,活化分子数增加,化学反应速率一定增大 | |
| B. | 升高温度,活化分子百分数增加,化学反应速率一定增大 | |
| C. | 加入反应物,使活化分子百分数增加,化学反应速率增大 | |
| D. | 使用催化剂,降低了反应的活化能、反应速率加快,但是活化分子百分数不变 |
5.胃舒平是氢氧化铝胶囊,常用来治疗胃酸(盐酸)过多.其原因是两者存在如下反应:Al(OH)3+3HCl═AlCl3+3H2O,问上述反应属于哪一基本反应类型?( )
| A. | 化合反应 | B. | 分解反应 | C. | 复分解反应 | D. | 置换反应 |
18.为除去粗盐中的Ca2+、Mg2+、SO${\;}_{4}^{2-}$以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,(用于沉淀的试剂一般过量),其中所加试剂顺序不正确的一组是.( )
| A. | BaCl2、Na2CO3、NaOH、盐酸 | B. | NaOH、BaCl2、Na2CO3、盐酸 | ||
| C. | Na2CO3、NaOH、BaCl2、盐酸 | D. | BaCl2、NaOH、Na2CO3、盐酸 |
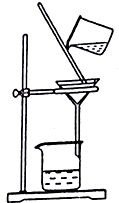
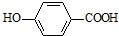 +CH2OH5$\stackrel{催化剂}{→}$
+CH2OH5$\stackrel{催化剂}{→}$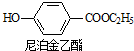 +H2O
+H2O