题目内容
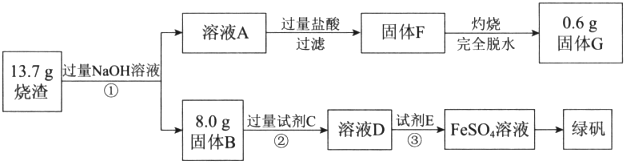
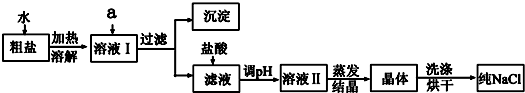
11.某化学课外活动小组用海带为原料制取了少量碘水.现用CCl4从碘水中萃取碘并用分液漏斗分离两种溶液.其实验操作可分解为如下几步:A.把盛有溶液的分液漏斗放在铁架台的铁圈中;
B.把50ml碘水和15mlCCl4加入分液漏斗中,并盖好玻璃塞;
C.取分液漏斗,且检验分液漏斗活塞和上口的玻璃塞是否漏液;
D.倒转漏斗用力振荡,并不时旋开活塞放气,最后关闭活塞,把分液漏斗放正;
E.从分液漏斗口倒出上层水溶液;
G.将漏斗上口玻璃塞打开或使塞上的凹槽或小孔对准漏斗上的小孔;旋开活塞,用烧杯接收下层液体
H.静置、分层.
就此实验完成下列各题:
(1)将C、D、G步骤补充完整.
C.检验分液漏斗活塞和上口的玻璃塞是否漏液;D并不时旋开活塞放气;G.将漏斗上口玻璃塞打开或使塞上的凹槽或小孔对准漏斗上的小孔
(2)正确操作步骤的顺序是(用上述各操作的编号字母填写):
C→B→D→A→H→G→_E.
(3)能用CCl4从碘水中萃取碘的原因是CCl4与水不互溶;而且碘在CCl4中的溶解度比在水中的大得多.
分析 (1)分液漏斗在使用前要检验是否漏水;振荡分液漏斗中的液体时,要不时旋开活塞放气,防止分液漏斗内气体压强过大;从分液漏斗向外放液体时,要使漏斗内外气体相通;
(2)CCl4从碘水中萃取碘并用分液漏斗分离两种溶液,其操作为查漏→装液→振荡→静置→分液;
(3)碘在水、四氯化碳中的溶解性不同.
解答 解:(1)分液漏斗在使用前要检验是否漏水,所以要检验分液漏斗活塞和上口的玻璃塞是否漏液;振荡分液漏斗中的液体时,要不时旋开活塞放气,防止分液漏斗内气体压强过大;从分液漏斗向外放液体时,要使漏斗内外气体相通,否则液体难以流下,所以要将漏斗上口玻璃塞打开或使塞上的凹槽或小孔对准漏斗上的小孔,然后旋开活塞,用烧杯接收下层液体;
故答案为:检验分液漏斗活塞和上口的玻璃塞是否漏液;并不时旋开活塞放气;将漏斗上口玻璃塞打开或使塞上的凹槽或小孔对准漏斗上的小孔;
(2)CCl4从碘水中萃取碘并用分液漏斗分离两种溶液,操作为查漏→装液→振荡→静置→分液,则步骤为C→B→D→A→H→G→E;
故答案为:C、B、D、A、H、G、E;
(3)CCl4是一种难溶于水的有机溶剂,选用CCl4从碘水中萃取碘的原因是CCl4与水不互溶,而且碘在CCl4中的溶解度比在水中的大得多;
故答案为:CCl4与水不互溶,而且碘在CCl4中的溶解度比在水中的大得多.
点评 本题考查混合物分离提纯,把握物质的性质选择分离、提纯的方法为解答的关键,侧重分离原理及分离实验步骤的考查,题目难度中等,试题有利于培养学生的分析、理解能力及化学实验能力.

练习册系列答案
 第三学期赢在暑假系列答案
第三学期赢在暑假系列答案 学练快车道快乐假期暑假作业新疆人民出版社系列答案
学练快车道快乐假期暑假作业新疆人民出版社系列答案
相关题目
12.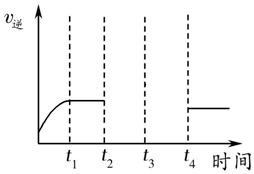 目前工业上可利用CO或CO2来生产燃料甲醇,某研究小组对下列有关甲醇制取的三条化学反应原理进行探究.已知在不同温度下的化学反应平衡常数(K1、K2、K3)如表所示:
目前工业上可利用CO或CO2来生产燃料甲醇,某研究小组对下列有关甲醇制取的三条化学反应原理进行探究.已知在不同温度下的化学反应平衡常数(K1、K2、K3)如表所示:
目前工业上可利用CO或CO2来生产燃料甲醇,某研究小组对下列有关甲醇制取的三条化学反应原理进行探究.已知在不同温度下的化学反应平衡常数(K1、K2、K3)如表所示:
请回答下列问题:
(1)反应②是吸热(填“吸热”或“放热”)反应.
(2)根据反应①与②可推导出K1、K2与K3之间的关系,则K3=K1×K2 (用K1、K2表示),
△H3═△H1+△H2 (用△H1、△H2表示);根据反应③判断△S<0(填“>”、“=”或“<”),在较低(填“较高”或“较低”)温度下有利于该反应自发进行.
(3)要使反应③在一定条件下建立的平衡正向移动,可采取的措施有ADF(填写字母序号).
A.缩小反应容器的容积 B.扩大反应容器的容积 C.升高温度
D.降低温度 E.使用合适的催化剂 F.从平衡体系中及时分离出CH3OH
(4)500°C时,测得反应③在某时刻,CO2(g)、H2(g)、CH3OH(g)、H2O(g)的浓度分别为0.1mol•L-1、0.3mol•L-1、0.3mol•L-1、0.15mol•L-1,则此时v正<v逆(填“>”、“=”或“<”).
(5)根据表格测得焓变,下列能量关系图合理的是AD.
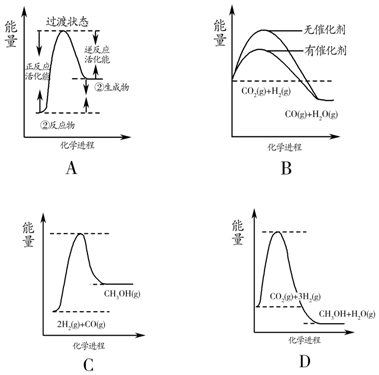
(6)某兴趣小组研究反应②的逆反应速率在下列不同条件下随时间的变化曲线,开始时升温,t1时平衡,t2时降压,t3时增加CO浓度,t4时又达到平衡.请画出t2至t4的曲线.
 目前工业上可利用CO或CO2来生产燃料甲醇,某研究小组对下列有关甲醇制取的三条化学反应原理进行探究.已知在不同温度下的化学反应平衡常数(K1、K2、K3)如表所示:
目前工业上可利用CO或CO2来生产燃料甲醇,某研究小组对下列有关甲醇制取的三条化学反应原理进行探究.已知在不同温度下的化学反应平衡常数(K1、K2、K3)如表所示:目前工业上可利用CO或CO2来生产燃料甲醇,某研究小组对下列有关甲醇制取的三条化学反应原理进行探究.已知在不同温度下的化学反应平衡常数(K1、K2、K3)如表所示:
| 化学反应 | 焓变 | 平衡常数 | 温度/℃ | ||
| 500 | 700 | 800 | |||
| ①2H2(g)+CO(g)?CH3OH(g) | △H1 | K1 | 2.5 | 0.34 | 0.15 |
| ②CO2(g)+H2(g)?CO(g)+H2O(g) | △H2 | K2 | 1.0 | 1.70 | 2.52 |
| ③CO2(g)+3H2(g)?CH3OH(g)+H2O(g) | △H3 | K3 | |||
(1)反应②是吸热(填“吸热”或“放热”)反应.
(2)根据反应①与②可推导出K1、K2与K3之间的关系,则K3=K1×K2 (用K1、K2表示),
△H3═△H1+△H2 (用△H1、△H2表示);根据反应③判断△S<0(填“>”、“=”或“<”),在较低(填“较高”或“较低”)温度下有利于该反应自发进行.
(3)要使反应③在一定条件下建立的平衡正向移动,可采取的措施有ADF(填写字母序号).
A.缩小反应容器的容积 B.扩大反应容器的容积 C.升高温度
D.降低温度 E.使用合适的催化剂 F.从平衡体系中及时分离出CH3OH
(4)500°C时,测得反应③在某时刻,CO2(g)、H2(g)、CH3OH(g)、H2O(g)的浓度分别为0.1mol•L-1、0.3mol•L-1、0.3mol•L-1、0.15mol•L-1,则此时v正<v逆(填“>”、“=”或“<”).
(5)根据表格测得焓变,下列能量关系图合理的是AD.

(6)某兴趣小组研究反应②的逆反应速率在下列不同条件下随时间的变化曲线,开始时升温,t1时平衡,t2时降压,t3时增加CO浓度,t4时又达到平衡.请画出t2至t4的曲线.
13.下列离子方程式正确的是( )
| A. | 稀硝酸滴在大理石上:CaCO3+2H+=Ca2++H2CO3 | |
| B. | 硫酸与氢氧化钡反应:H++SO42-+Ba2++OH-═BaSO4↓+H2O | |
| C. | 氧化铜与稀硫酸反应:2H++O2-═H2O | |
| D. | 碳酸钠溶液中加入盐酸:CO32-+2H+═CO2↑+H2O |
10.下列现象或事实的解释正确的是( )
| A. | Al2O3作耐火材料是因为氧化铝熔点高 | |
| B. | 光导纤维具有很强的导电能力,应用于制造通信光缆 | |
| C. | 过氧化钠用于呼吸面具中是因为过氧化钠是强氧化剂能氧化CO2和水 | |
| D. | FeCl3溶液可用于铜质印刷线路板制作是因为FeCl3能与铜单质发生置换反应 |
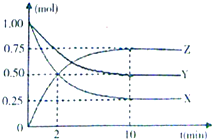 某温度时,在一个容积为2L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示.
某温度时,在一个容积为2L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示.