题目内容
19.下列属于化学变化的是( )| A. | 煤的干馏 | B. | 石油的裂解 | C. | 煤的气化 | D. | 石油的分馏 |
分析 化学变化是指有新物质生成的变化.物理变化是指没有新物质生成的变化.化学变化和物理变化的本质区别是否有新物质生成.
解答 解:A.煤的干馏是隔绝空气加强热发生复杂的物理化学变化,属于化学变化,故A正确;
B.石油裂解是催化剂作用下发生化学反应生成烷烃和烯烃,属于化学变化,故B正确;
C.煤的气化使发生反应生成一氧化碳和氢气,发生了化学变化,故C正确;
D.石油分馏是依据物质沸点不同分离混合物,故D错误;
故选ABC.
点评 本题考查了物质变化的实质,解答本题要分析变化过程中是否有新物质生成,如果有新物质生成就属于化学变化,题目难度不大.

练习册系列答案
 全能测控期末小状元系列答案
全能测控期末小状元系列答案
相关题目
9.下列离子方程式书写正确的是( )
| A. | 氧化铁与稀硫酸反应:Fe2O3+6H+═Fe2++3H2O | |
| B. | 石灰石溶于盐酸中:CO32-+2H+═CO2↑+H2O | |
| C. | 硫酸铜溶液与氢氧化钠溶液混合:Cu2++2OH-═Cu(OH)2↓ | |
| D. | 碳酸氢钙溶液与盐酸反应:HCO3-+H+═H2O+CO2↑ |
10.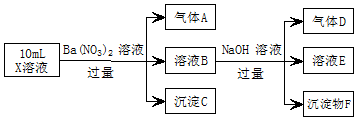 某强酸性溶液X中可能含有Fe2+、A13+、NH4+、CO32-、SO42-、C1-中的若干种,现取X溶液进行实验,实验过程及产物如图:下列说法正确的是( )
某强酸性溶液X中可能含有Fe2+、A13+、NH4+、CO32-、SO42-、C1-中的若干种,现取X溶液进行实验,实验过程及产物如图:下列说法正确的是( )
 某强酸性溶液X中可能含有Fe2+、A13+、NH4+、CO32-、SO42-、C1-中的若干种,现取X溶液进行实验,实验过程及产物如图:下列说法正确的是( )
某强酸性溶液X中可能含有Fe2+、A13+、NH4+、CO32-、SO42-、C1-中的若干种,现取X溶液进行实验,实验过程及产物如图:下列说法正确的是( )| A. | A是一种无色、无毒的气体 | |
| B. | 沉淀F为Fe(OH)2 | |
| C. | 实验室可用排水法收集气体D | |
| D. | 往溶液E中通入少量CO2,有沉淀产生 |
7.在含有大量Ba2+、H+、NO${\;}_{3}^{-}$的溶液中,还可能大量共存的离子是( )
| A. | Fe2+ | B. | NH${\;}_{4}^{+}$ | C. | HCO${\;}_{3}^{-}$ | D. | OH- |
14.下列物质属于纯净物的是( )
| A. | 铝热剂 | B. | 福尔马林 | C. | 干冰 | D. | 碘酒 |
11.下列反应的离子方程式正确的是 ( )
| A. | 铜跟浓HNO3反应:Cu+4H++2NO3-═Cu2++2NO2↑+2H2O | |
| B. | 向氯化铝溶液中加入过量氨水:Al3++3OH-═AlO2-+2H2O | |
| C. | 向水通入中NO2:3NO2+H2O═2H++2NO3-+NO | |
| D. | NH4Cl溶液和AgNO3溶液混合:NH4Cl+Ag +═Ag Cl↓+NH4+ |
8.下列物质中,既含有极性键又含有非极性键的是( )
| A. | CO2 | B. | CH4 | C. | C2H4 | D. | NH4Cl |
8. 氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用.请回答下列问题.
氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用.请回答下列问题.
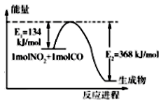
(1)如图是1mol NO2和1mol CO反应生成CO2和NO过程中能量变化示意图(图中涉及物质为气态),请写出NO2和CO反应的热化学方程式NO2(g)+CO(g)=NO(g)+CO2(g)△H=-234 kJ•mol-1.
(2)在体积为3L的恒容密闭容器中,投入4molN2和9molH2,在一定条件下合成氨,不同温度下测得的数据如表所示:
已知:破坏1molN2(g)和3molH2(g)中的化学键消耗的总能量小于破坏2molNH3(g)中的化学键消耗的能量.
①则T1<T2 (填“>”“<”或“=”)
②在T2K下,经过5min达到化学平衡状态,则0~5min内H2的平均速率v(H2)=0.2mol•L-1•min-1.
平衡时N2的转化率α(N2)=25%.若再增加氢气浓度,该反应的平衡常数将不变(填“增大”、“减小”或“不变”).
(3)以N2、H2为电极反应物,以HCl-NH4Cl为电解质溶液制造新型燃料电池,放电过程中,溶液中NH4+浓度逐渐增大,写出该电池的正极反应式:N2+8H++6e-═2NH4+.
(4)已知室温下当NH4Cl溶液的浓度小于0.1mol/L时,其pH>5.1.现用0.1mol/L的盐酸滴定10mL0.05mol/K的氨水,用甲基橙做指示剂达到终点时所用盐酸的量应是大于5mL.(填“大于”、“小于”或“等于”),此时溶液中离子浓度大小顺序为c (Cl-)>c(NH4+)>c(H+)>c(OH-).
 氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用.请回答下列问题.
氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用.请回答下列问题.(1)如图是1mol NO2和1mol CO反应生成CO2和NO过程中能量变化示意图(图中涉及物质为气态),请写出NO2和CO反应的热化学方程式NO2(g)+CO(g)=NO(g)+CO2(g)△H=-234 kJ•mol-1.
(2)在体积为3L的恒容密闭容器中,投入4molN2和9molH2,在一定条件下合成氨,不同温度下测得的数据如表所示:
| 温度(K) | 平衡时NH3的物质的量(mol) |
| T1 | 2.4 |
| T2 | 2.0 |
①则T1<T2 (填“>”“<”或“=”)
②在T2K下,经过5min达到化学平衡状态,则0~5min内H2的平均速率v(H2)=0.2mol•L-1•min-1.
平衡时N2的转化率α(N2)=25%.若再增加氢气浓度,该反应的平衡常数将不变(填“增大”、“减小”或“不变”).
(3)以N2、H2为电极反应物,以HCl-NH4Cl为电解质溶液制造新型燃料电池,放电过程中,溶液中NH4+浓度逐渐增大,写出该电池的正极反应式:N2+8H++6e-═2NH4+.
(4)已知室温下当NH4Cl溶液的浓度小于0.1mol/L时,其pH>5.1.现用0.1mol/L的盐酸滴定10mL0.05mol/K的氨水,用甲基橙做指示剂达到终点时所用盐酸的量应是大于5mL.(填“大于”、“小于”或“等于”),此时溶液中离子浓度大小顺序为c (Cl-)>c(NH4+)>c(H+)>c(OH-).