题目内容
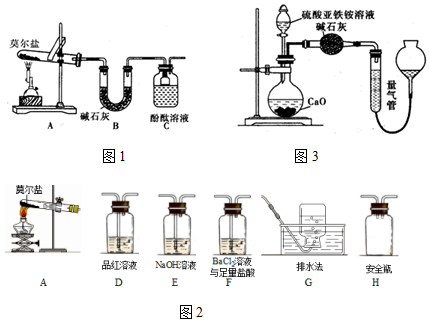
10.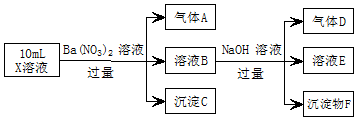 某强酸性溶液X中可能含有Fe2+、A13+、NH4+、CO32-、SO42-、C1-中的若干种,现取X溶液进行实验,实验过程及产物如图:下列说法正确的是( )
某强酸性溶液X中可能含有Fe2+、A13+、NH4+、CO32-、SO42-、C1-中的若干种,现取X溶液进行实验,实验过程及产物如图:下列说法正确的是( )| A. | A是一种无色、无毒的气体 | |
| B. | 沉淀F为Fe(OH)2 | |
| C. | 实验室可用排水法收集气体D | |
| D. | 往溶液E中通入少量CO2,有沉淀产生 |
分析 强酸性溶液含大量的氢离子,一定不会存在CO32-,结合实验流程可知,加入过量硝酸钡生成沉淀,则该沉淀C为BaSO4,说明溶液中含有SO42-离子,生成气体A,因Fe、硝酸根离子、氢离子发生氧化还原反应,则A为NO,说明溶液中含有还原性离子,一定含Fe2+离子;溶液B中加入过量NaOH溶液,生成气体D,则D为NH3,说明溶液中含有NH4+离子,沉淀物F为Fe(OH)3,溶液E中含NaOH、硝酸钠,且E中可能含偏铝酸钠,以此来解答.
解答 解:由上述分析可知,X中一定含Fe2+、NH4+、SO42-,可能含A13+、C1-,一定不含CO32-,
A.A为NO,为无色有毒气体,故A错误;
B.由3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O,B中含氧化还原反应生成的铁离子,与NaOH反应生成F为Fe(OH)3,故B错误;
C.D为氨气,极易溶于水,不能用排水法收集,故C错误;
D.E中含NaOH、硝酸钠,可能含偏铝酸钠,通入二氧化碳可发生CO2+OH-=HCO3-、2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32-、AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-,则往溶液E中通入少量CO2,可能有沉淀产生,故D正确;
故选D.
点评 本题考查无机物的推断,为高频考点,把握物质的性质、发生的反应、元素化合物等为解答的关键,侧重分析与推断能力的考查,注意氧化还原反应的应用,题目难度不大.

练习册系列答案
 快乐5加2金卷系列答案
快乐5加2金卷系列答案
相关题目
15.下列叙述错误的是( )
| A. | 用金属钠可区分乙醇和乙醚 | |
| B. | 用高锰酸钾酸性溶液可区分己烷和3-己烯 | |
| C. | 用水可区分苯和溴苯 | |
| D. | 用溴的四氯化碳溶液可区分乙烯和乙炔 |
1.pH=1的某溶液X中仅含有NH4+、Al3+、Ba2+、Fe2+、Fe3+、CO32-、SO32-、SO42-、Cl-、NO3-中的一种或几种(忽略水的电离及离子的水解),取该溶液进行连续实验,实验过程如图:下列有关推断不正确的是( )


| A. | 溶液X中一定含有H+、Al3+、NH4+、Fe2+、SO42- | |
| B. | 根据上述连续实验不能确定溶液X中是否含有Fe3+、Cl- | |
| C. | 沉淀H为Al(OH)3、BaCO3的混合物 | |
| D. | 若溶液X为100mL,产生的气体A为44.8mL(标准状况),则X中c(Fe2+)=0.06mol•L-1 |
15.在一定温度下将lmol CO(g)和lmol H2O(g)通入一个容积固定的密闭容器中发生下列反应:CO(g)+H2O(g)?CO2(g)+H2(g)达到平衡后CO2的物质的量为a mol,再通入4molH2O(g),当再次达到平衡后,H2的物质的量n(H2)可能是( )
| A. | n(H2)═a mol | B. | n(H2)═1 mol | ||
| C. | a mol<n(H2)<1 mol | D. | 1 mol<n(H2)<4 mol |
2. 铁碳微电解技术是利用原电池原理处理酸性污水的一种工艺,装置如图.若上端开口关闭,可得到强还原性的H•(氢原子);若上端开口打开,并鼓入空气,可得到强氧化性的•OH(羟基自由基).下列说法正确的是( )
铁碳微电解技术是利用原电池原理处理酸性污水的一种工艺,装置如图.若上端开口关闭,可得到强还原性的H•(氢原子);若上端开口打开,并鼓入空气,可得到强氧化性的•OH(羟基自由基).下列说法正确的是( )
 铁碳微电解技术是利用原电池原理处理酸性污水的一种工艺,装置如图.若上端开口关闭,可得到强还原性的H•(氢原子);若上端开口打开,并鼓入空气,可得到强氧化性的•OH(羟基自由基).下列说法正确的是( )
铁碳微电解技术是利用原电池原理处理酸性污水的一种工艺,装置如图.若上端开口关闭,可得到强还原性的H•(氢原子);若上端开口打开,并鼓入空气,可得到强氧化性的•OH(羟基自由基).下列说法正确的是( )| A. | 无论是否鼓入空气,负极的电极反应式均为Fe-3e-=Fe3+ | |
| B. | 鼓入空气时,每生成1mol•OH有2mol电子发生转移 | |
| C. | 不鼓入空气时,正极的电极反应式为H++e-=H• | |
| D. | 处理含有C2O42-的污水时,上端开口应关闭 |
19.下列属于化学变化的是( )
| A. | 煤的干馏 | B. | 石油的裂解 | C. | 煤的气化 | D. | 石油的分馏 |
20.关于碱金属单质的性质叙述错误的是( )
| A. | 都能够在空气中剧烈燃烧 | |
| B. | 都能够与水反应生成碱和H2 | |
| C. | 都可以保存在煤油中 | |
| D. | 都是密度比较小、熔点比较低的金属 |