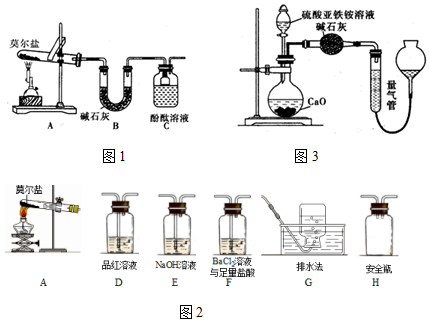
题目内容
9.下列离子方程式书写正确的是( )| A. | 氧化铁与稀硫酸反应:Fe2O3+6H+═Fe2++3H2O | |
| B. | 石灰石溶于盐酸中:CO32-+2H+═CO2↑+H2O | |
| C. | 硫酸铜溶液与氢氧化钠溶液混合:Cu2++2OH-═Cu(OH)2↓ | |
| D. | 碳酸氢钙溶液与盐酸反应:HCO3-+H+═H2O+CO2↑ |
分析 A.氧化铁与稀硫酸反应生成的是铁离子;
B.石灰石的主要成分为碳酸钙,碳酸钙不能拆开;
C.硫酸铜与氢氧化钠溶液反应生成氢氧化铜和硫酸钠;
D.碳酸氢钙与盐酸反应生成氯化钙、二氧化碳和水.
解答 解:A.氧化铁与稀硫酸反应硫酸铁和水,正确的离子方程式为:Fe2O3+6H+═2Fe3++3H2O,故A错误;
B.碳酸钙不能拆开,正确的离子方程式为:CaCO3+2H+=Ca2++H2O+CO2↑,故B错误;
C.硫酸铜溶液与氢氧化钠溶液混合,二者反应生成氢氧化铜沉淀,反应的离子方程式为:Cu2++2OH-═Cu(OH)2↓,故C正确;
D.碳酸氢钙溶液与盐酸反应的离子方程式为:HCO3-+H+═H2O+CO2↑,故D正确;
故选CD.
点评 本题考查了离子方程式的书写判断,为高考的高频题,题目难度不大,注意掌握离子方程式的书写原则,明确离子方程式正误判断常用方法:检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合原化学方程式等.

练习册系列答案
相关题目
14.下列分子中,空间构型为v型的是( )
| A. | NH3 | B. | CCl4 | C. | H2O | D. | CH2O |
15.下列叙述错误的是( )
| A. | 用金属钠可区分乙醇和乙醚 | |
| B. | 用高锰酸钾酸性溶液可区分己烷和3-己烯 | |
| C. | 用水可区分苯和溴苯 | |
| D. | 用溴的四氯化碳溶液可区分乙烯和乙炔 |
12.将一定量的CuS投入足量的HNO3中,收集到标准状况下的气体VL向反应后的溶液中加人足量的NaOH,产生蓝色沉淀,经过滤、洗涤、灼烧,得到CuO16g,若上述气体为NO和NO2的混合物,且体积比为1:1,则V为( )
| A. | 9.0L | B. | 13.44L | C. | 17.92L | D. | 16.8L |
4.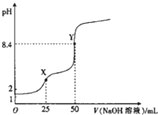 用0.1mot•L-1的NaOH溶液滴定25mL0.1mol•L-1 H2C2O4(草酸)溶液的滴定曲线如图所示,下列说法不正确的是( )
用0.1mot•L-1的NaOH溶液滴定25mL0.1mol•L-1 H2C2O4(草酸)溶液的滴定曲线如图所示,下列说法不正确的是( )
 用0.1mot•L-1的NaOH溶液滴定25mL0.1mol•L-1 H2C2O4(草酸)溶液的滴定曲线如图所示,下列说法不正确的是( )
用0.1mot•L-1的NaOH溶液滴定25mL0.1mol•L-1 H2C2O4(草酸)溶液的滴定曲线如图所示,下列说法不正确的是( )| A. | 草酸是弱酸 | |
| B. | X点:c(H2C2O4)+c(HC2O4-)=c (Na+)-c(C2O42-) | |
| C. | Y 点:c(H2C2O4)+c(HC2O4-)=c(OH-)-C(H+) | |
| D. | 滴定过程中始终存在:c(OH-)+2c(C2O42-)+c(HC2O4-)=c(Na+)+c(H+) |
14.若$\frac{1}{2}$H2(g)+$\frac{1}{2}$Cl2(g)═HCl(g)△H=-92.3kJ/mol,则HCl(g)═$\frac{1}{2}$H2(g)+$\frac{1}{2}$Cl2(g)的△H为( )
| A. | +184.6 kJ/mol | B. | -92.3 kJ/mol | C. | -369.2 kJ/mol | D. | +92.3 kJ/mol |
1.pH=1的某溶液X中仅含有NH4+、Al3+、Ba2+、Fe2+、Fe3+、CO32-、SO32-、SO42-、Cl-、NO3-中的一种或几种(忽略水的电离及离子的水解),取该溶液进行连续实验,实验过程如图:下列有关推断不正确的是( )
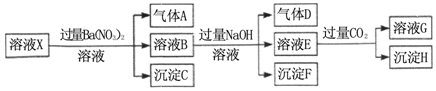

| A. | 溶液X中一定含有H+、Al3+、NH4+、Fe2+、SO42- | |
| B. | 根据上述连续实验不能确定溶液X中是否含有Fe3+、Cl- | |
| C. | 沉淀H为Al(OH)3、BaCO3的混合物 | |
| D. | 若溶液X为100mL,产生的气体A为44.8mL(标准状况),则X中c(Fe2+)=0.06mol•L-1 |
19.下列属于化学变化的是( )
| A. | 煤的干馏 | B. | 石油的裂解 | C. | 煤的气化 | D. | 石油的分馏 |