题目内容
7.在含有大量Ba2+、H+、NO${\;}_{3}^{-}$的溶液中,还可能大量共存的离子是( )| A. | Fe2+ | B. | NH${\;}_{4}^{+}$ | C. | HCO${\;}_{3}^{-}$ | D. | OH- |
分析 根据离子之间不能结合生成沉淀、气体、水等,不能发生氧化还原反应等,则离子大量共存,以此来解答.
解答 解:A.Fe2+、H+、NO3-发生氧化还原反应,不能共存,故A不选;
B.铵根离子与该组离子之间不反应,可大量共存,故B选;
C.H+、HCO3-结合生成气体和水,不能共存,故C不选;
D.H+、OH-结合生成水,不能共存,故D不选;
故选B.
点评 本题考查离子共存,为高频考点,把握常见离子之间的反应为解答的关键,侧重分析与应用能力的考查,注意复分解反应、氧化还原反应的判断,题目难度不大.

练习册系列答案
相关题目
12.将一定量的CuS投入足量的HNO3中,收集到标准状况下的气体VL向反应后的溶液中加人足量的NaOH,产生蓝色沉淀,经过滤、洗涤、灼烧,得到CuO16g,若上述气体为NO和NO2的混合物,且体积比为1:1,则V为( )
| A. | 9.0L | B. | 13.44L | C. | 17.92L | D. | 16.8L |
15.在一定温度下将lmol CO(g)和lmol H2O(g)通入一个容积固定的密闭容器中发生下列反应:CO(g)+H2O(g)?CO2(g)+H2(g)达到平衡后CO2的物质的量为a mol,再通入4molH2O(g),当再次达到平衡后,H2的物质的量n(H2)可能是( )
| A. | n(H2)═a mol | B. | n(H2)═1 mol | ||
| C. | a mol<n(H2)<1 mol | D. | 1 mol<n(H2)<4 mol |
2.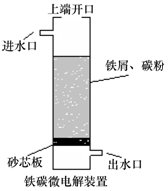 铁碳微电解技术是利用原电池原理处理酸性污水的一种工艺,装置如图.若上端开口关闭,可得到强还原性的H•(氢原子);若上端开口打开,并鼓入空气,可得到强氧化性的•OH(羟基自由基).下列说法正确的是( )
铁碳微电解技术是利用原电池原理处理酸性污水的一种工艺,装置如图.若上端开口关闭,可得到强还原性的H•(氢原子);若上端开口打开,并鼓入空气,可得到强氧化性的•OH(羟基自由基).下列说法正确的是( )
 铁碳微电解技术是利用原电池原理处理酸性污水的一种工艺,装置如图.若上端开口关闭,可得到强还原性的H•(氢原子);若上端开口打开,并鼓入空气,可得到强氧化性的•OH(羟基自由基).下列说法正确的是( )
铁碳微电解技术是利用原电池原理处理酸性污水的一种工艺,装置如图.若上端开口关闭,可得到强还原性的H•(氢原子);若上端开口打开,并鼓入空气,可得到强氧化性的•OH(羟基自由基).下列说法正确的是( )| A. | 无论是否鼓入空气,负极的电极反应式均为Fe-3e-=Fe3+ | |
| B. | 鼓入空气时,每生成1mol•OH有2mol电子发生转移 | |
| C. | 不鼓入空气时,正极的电极反应式为H++e-=H• | |
| D. | 处理含有C2O42-的污水时,上端开口应关闭 |
12.下列说法正确的是( )
| A. | 苯在一定条件下可以和H2反应 | B. | 甲烷和乙醇都属于饱和烃 | ||
| C. | 一氯甲烷分子式为CH4Cl | D. | 乙烷和乙烯是同系物 |
19.下列属于化学变化的是( )
| A. | 煤的干馏 | B. | 石油的裂解 | C. | 煤的气化 | D. | 石油的分馏 |
16.“低碳经济,节能减排”是当今世界经济发展的新思路.”下列与之相悖的是( )
| A. | 着力开发风能、太阳能、地热能等清洁高效新能源,减少煤、石油等化石燃料的使用 | |
| B. | 为了减少SO2和NOx的排放,工业废气排放到大气之前必须回收处理 | |
| C. | 大力开采煤、石油和天然气,以满足经济发展和日常生活的需要 | |
| D. | 大力发展混合动力汽车、电动汽车等新能源汽车,以减少对化石能源的依赖,保护城乡环境,关爱人类生存空间 |
17.下列有关溶液组成的描述合理的是( )
| A. | 无色溶液中可能大量存在Al3+、NH4+、Cl-、S2- | |
| B. | pH=1的溶液中大量存在Na+、NH4+、SiO32-、I- | |
| C. | 弱碱性溶液中可能大量存在Na+、K+、Cl-、HCO3- | |
| D. | 0.1mol•L-1NaAlO2溶液中可能大量存在Na+、H+、Cl-、SO42- |