题目内容
12.两种气态烃组成的混合物共0.1mol,完全燃烧后得到4.48L CO2(标准状况)和4.5g水,则这两种气体可能是( )| A. | CH4和C3H6 | B. | CH4和C2H4 | C. | CH4和C3H8 | D. | CH4和C4H6 |
分析 n(CO2)=$\frac{4.48L}{22.4L/mol}$=0.2mol,n(H2O)=$\frac{4.5g}{18g/mol}$=0.25mol,根据C、H原子守恒,则混合的平均化学式为C2H5,结合平均C、H原子数目计算判断.
解答 解:n(CO2)=$\frac{4.48L}{22.4L/mol}$=0.2mol,n(H2O)=$\frac{4.5g}{18g/mol}$=0.25mol,根据C、H原子守恒,则混合的平均化学式为C2H5.
A.设CH4和C3H6的物质的量分别为xmol、ymol,根据平均C原子数目,则$\frac{x+3y}{x+y}$=2,整理得x:y=1:1,二者1:1混合时平均H原子数目为$\frac{4+6}{2}$=5,符合题意,故A正确;
B.CH4和C2H4以任意比混合,平均H原子数目都是4,平均碳原子数目介于1~2之间,不符合,故B错误;
C.由A中计算可知CH4和C3H8的物质的量比为1:1时平均C原子数目=2,而平均H原子数目为$\frac{4+8}{2}$=6,不符合,故C错误;
D.设CH4和C4H6的物质的量分别为xmol、ymol,根据平均H原子数目,则$\frac{4x+6y}{x+y}$=5,整理可得x:y=1:1,此时平均C原子数目为$\frac{1+4}{2}$=2.5,不符合题意,故D错误.
故选:A.
点评 本题考查分子式的确定、混合物计算,题目难度中等,关键是利用平均分子组成判断烃的组成,常用方法有:1、平均碳法 2、平均氢法 3、平均碳氢分子式法 4、平均式量法.

练习册系列答案
 口算能手系列答案
口算能手系列答案
相关题目
7.下列鉴别方法不可行的是( )
| A. | 用燃烧法鉴别乙醇、苯和四氯化碳 | |
| B. | 用酸性高锰酸钾溶液鉴别苯、环己烯和环己烷 | |
| C. | 用碳酸钠溶液鉴别乙醇、乙酸和乙酸乙酯 | |
| D. | 用水鉴别乙醇、苯和溴苯 |
1.某烷烃4.5g充分燃烧,将生成的气体通入过量澄清的石灰水中,得沉淀30g,这种烷烃是( )
| A. | 甲烷 | B. | 乙烷 | C. | 丙烷 | D. | 丁烷 |


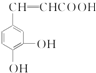 跟碳酸氢钠:
跟碳酸氢钠: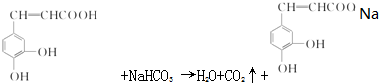 .
.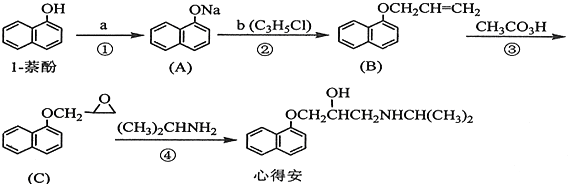
 ;由F生成一硝基产物的化学方程式为
;由F生成一硝基产物的化学方程式为 .
.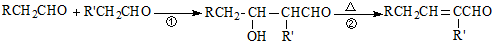

 ,B
,B .
. +
+ $→_{△}^{浓硫酸}$
$→_{△}^{浓硫酸}$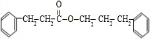 +H2O.
+H2O.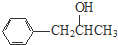 、
、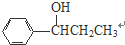 、
、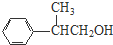 、
、 .
.