题目内容
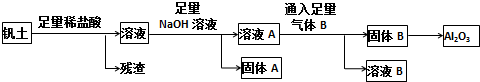
3.将Na2CO3和NaHCO3混合物19g,充分加热后,收集到CO2有1.12L(标准状况),冷却后将剩余固体溶于300mL水中,配为一定浓度的溶液.求:(1)原混合物中Na2CO3的质量.
(2)所配制的溶液的物质的量浓度.
分析 (1)固体加热时发生2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O,由生成的二氧化碳气体可计算原混合物中NaHCO3质量,进而计算碳酸钠的质量;
(2)反应后的固体中只有Na2CO3,为生成的碳酸钠与原混合物中碳酸钠之和,根据二氧化碳计算生成的碳酸钠的物质的量,根据n=$\frac{m}{M}$计算原混合物中碳酸钠的物质的量,根据c=$\frac{n}{V}$计算碳酸钠溶液的物质的量浓度.
解答 解:(1)收集到CO2有1.12L,其物质的量为$\frac{1.12L}{22.4L/mol}$=0.05mol,则:
2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O,
2 1 1
0.1mol 0.05mol 0.05mol
所以m(NaHCO3)=0.05mol×168g=8.4g,
故原混合物中碳酸钠的质量为19g-8.4g=10.6g,
答:原混合物中Na2CO3的质量为10.6g;
(2)原混合物中Na2CO3的物质的量为$\frac{10.6g}{106g/mol}$=0.1mol,
故反应后的Na2CO3的总的物质的量为0.1mol+0.05mol=0.15mol,
碳酸钠溶液的物质的量浓度为$\frac{0.15mol}{0.3L}$=0.5mol/L,
答:碳酸钠溶液的物质的量浓度为0.5mol/L.
点评 本题考查混合物的有关计算、化学方程式的计算等,难度不大,关键是明确发生的反应,掌握以物质的量为中心的计算.

练习册系列答案
相关题目
13.碳酸钠和碳酸氢钠是生活中常见的盐,下列说法错误的是( )
| A. | 可通入过量的CO2气体来除去NaHCO3溶液中少量的Na2CO3杂质 | |
| B. | 可采用滴加少量的澄清石灰水来鉴别Na2CO3和NaHCO3两种白色固体 | |
| C. | 等质量的Na2CO3和NaHCO3分别与足量的盐酸反应,后者放出的CO2多 | |
| D. | 通过称取ag Na2CO3和NaHCO3的混合物经充分加热冷却后恒重bg能够测出混合物中Na2CO3的质量分数 |
11.正确掌握化学用语是学好化学的基础,下列化学用语正确的是( )
| A. | 苯的分子式为C6H6 | B. | 乙烯的结构简式为CH2CH2 | ||
| C. | 四氯化碳的电子式: | D. | 硫离子结构示意图: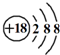 |
12.两种气态烃组成的混合物共0.1mol,完全燃烧后得到4.48L CO2(标准状况)和4.5g水,则这两种气体可能是( )
| A. | CH4和C3H6 | B. | CH4和C2H4 | C. | CH4和C3H8 | D. | CH4和C4H6 |
13.如图是部分短周期元素原子半径与原子序数的关系图.则下列说法正确的是( )
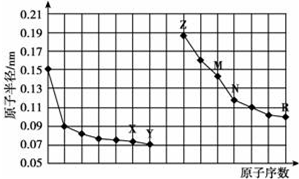

| A. | 简单离子的半径:X<Z<M | |
| B. | 最高价氧化物对应水化物的酸性:R<N | |
| C. | Y、R两种元素的气态氢化物稳定性:Y>R | |
| D. | 由X与N两种元素组成的化合物不能与任何酸反应,但能与强碱反应 |
 .
. .
. .
.