题目内容
2.甲醇(CH3OH)是重要的溶剂和替代燃料,工业常以CO和H2的混合气体为原料一定条件下制备甲醇.(1)甲醇与乙醇互为同系物;完全燃烧时,甲醇与同物质的量的汽油(设平均组成为C8H18)消耗O2量之比为3:25.
(2)工业上常用“水煤气法”获得CO和H2,其反应原理如下:
C(s)+H2O(g)?CO(g)+H2(g) CO(g)+H2O(g)?CO2(g)+H2(g)
某水煤气样品中含0.2L CO、0.5L CO2,则该样品中含H21.2L.
(3))工业上还可以通过下列途径获得H2,其中节能效果最好的是D
A.高温分解水制取H2:2H2O$\frac{\underline{\;高温\;}}{\;}$2H2↑+O2↑
B.电解水制取H2:2H2O$\frac{\underline{\;通电\;}}{\;}$2H2↑+O2↑
C.甲烷与水反应制取H2:CH4+H2O$\stackrel{高温}{?}$3H2+CO
D.在光催化剂作用下,利用太阳能分解水制取H2:2H2O$\frac{\underline{\;\;\;TiO_{2}\;\;\;}}{太阳光}$2H2↑+O2↑
分析 (1)甲醇与乙醇结构相似,为同系物,根据燃烧的通式(x+$\frac{y}{4}$-$\frac{z}{2}$)计算耗氧量;
(2)由反应C(s)+H2O(g)?CO(g)+H2(g) CO(g)+H2O(g)?CO2(g)+H2(g)可知,H2O中的H生成氢气,O生成CO或二氧化碳,结合质量守恒计算;
(3)通过不同途径获得H2,如节约能源,可利用太阳能.
解答 解:(1)甲醇与乙醇结构相似,二者分子式不同,互为同系物,甲醇(CH4O)与同物质的量的汽油(设平均组成为C8H18)消耗O2量之比为(1+$\frac{4}{4}$-$\frac{1}{2}$):(8+$\frac{18}{4}$)=3:25;
故答案为:同系物;3:25;
(2)由反应C(s)+H2O(g)?CO(g)+H2(g) CO(g)+H2O(g)?CO2(g)+H2(g)可知,H2O中的H生成氢气,O生成CO或二氧化碳,则产物中存在n(O)=n(H2),可知n(H2)=n(CO)+2n(CO2)=0.2L+0.5L×2=1.2L,
故答案为:1.2;
(3)通过不同途径获得H2,如节约能源,可利用太阳能,题中其它选项消耗热能、电能,不符合要求,故答案为:D.
点评 本题考查较为综合,涉及有机物的结构和性质,化学方程式的计算以及能源问题,为高考常见题型,侧重于学生的分析能力和计算能力的考查,题目难度不大,有利于培养学生良好的科学素养.

练习册系列答案
 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案
相关题目
12.两种气态烃组成的混合物共0.1mol,完全燃烧后得到4.48L CO2(标准状况)和4.5g水,则这两种气体可能是( )
| A. | CH4和C3H6 | B. | CH4和C2H4 | C. | CH4和C3H8 | D. | CH4和C4H6 |
13.如图是部分短周期元素原子半径与原子序数的关系图.则下列说法正确的是( )
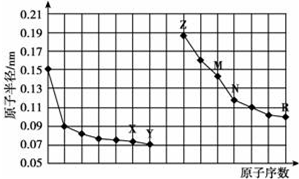

| A. | 简单离子的半径:X<Z<M | |
| B. | 最高价氧化物对应水化物的酸性:R<N | |
| C. | Y、R两种元素的气态氢化物稳定性:Y>R | |
| D. | 由X与N两种元素组成的化合物不能与任何酸反应,但能与强碱反应 |
17.下列对各组物质性质的比较中,正确的是( )
| A. | 沸点:HF<HCl | B. | 熔点:Al>Na | C. | 密度:H2O>MgCl2 | D. | 硬度:C<Si |
12.用锌与稀硫酸反应制H2时,下列能延缓反应速率但又不影响生成氢气总量的是( )
| A. | 加入少量NaNO3溶液 | B. | 加入少量CuSO4溶液 | ||
| C. | 加入少量CH3COONa固体 | D. | 改用98%的浓硫酸 |
10.常温下,下列各组离子或分子组能大量共存且满足相应要求的是( )
| 选项 | 离 子 | 要 求 |
| A | K+、AlO2-、Cl-、MnO4- | c(K+)<c(Cl-) |
| B | Fe3+、NO3-、I-、HCO3- | 逐滴加入盐酸立即有气体产生 |
| C | NH4+、Al3+、SO42-、CH2COOH | 逐滴加入NaOH溶液立即有气体产生 |
| D | Na+、Cu2、Cl-、SO42- | 逐滴加氨水先有沉淀产生,后沉淀消失 |
| A. | A | B. | B | C. | C | D. | D |
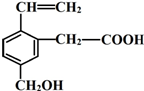 某有机物的结构简式如图,该物质不应有的化学性质是⑥⑦
某有机物的结构简式如图,该物质不应有的化学性质是⑥⑦
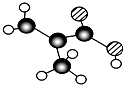 ,分子中共有12个原子(图中球与球之间的连线代表单键、双键等化学键).
,分子中共有12个原子(图中球与球之间的连线代表单键、双键等化学键).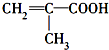 .
.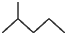 表示的有机物C的分子式为C6H14.
表示的有机物C的分子式为C6H14.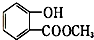 中含有的官能团的名称为羟基、酯基.
中含有的官能团的名称为羟基、酯基.