题目内容
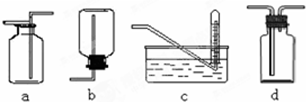
2.为验证氯气的性质,某小组用如图所示的微型实验装置进行试验,a、b、c、d、e、是浸有相关溶液的滤纸.小组同学用KMnO4晶体与浓盐酸反应来制取少量的氯气,向KMnO4晶体滴加一滴浓盐酸后,立即用另一培养皿扣在上面.其化学方程式为:KMnO4+HCl(浓)→KCl+Cl2↑+MnCl2+H2O (未配平),请回答下列问题:
(1)上述反应中,Cl元素的化合价升高;而Mn 元素被还原.
(2)配平上述反应:
2 KMnO4+16 HCl(浓)═2 KCl+5 Cl2↑+2 MnCl2+8 H2O
(3)c处湿润蓝色石蕊试纸会先变红后褪色,产生此现象的原因是:氯水具有酸性和漂白性.
(4)e处滤纸的实验现象是:血红色,写出氯气与Fe2+反应的离子方程式是:2Fe2++Cl2=2Fe3++2Cl-.
(5)上述反应若在标准状况下产生56L的氯气,则转移电子为5mol.
分析 (1)Mn元素的化合价降低,Cl元素的化合价升高;
(2)结合电子、原子守恒配平;
(3)氯气与水反应生成HCl和HClO,具有酸性、漂白性;
(4)e处发生2Fe2++Cl2=2Fe3++2Cl-,铁离子遇KSCN溶液为血红色;
(5)在标准状况下产生56L的氯气,n(Cl2)=$\frac{56L}{22.4L/mol}$=2.5mol,结合元素的化合价变化计算.
解答 解:(1)Mn元素的化合价降低,Cl元素的化合价升高,则Mn元素被还原,故答案为:Cl;Mn;
(2)由电子、原子守恒可知反应为2KMnO4+16HCl=2KCl+5Cl2↑+2MnCl2+8H2O,故答案为:2;16;2;5;2;8;
(3)氯气与水反应生成HCl和HClO,具有酸性、漂白性,则处湿润蓝色石蕊试纸会先变红后褪色,产生此现象的原因是氯水具有酸性和漂白性,
故答案为:变红;褪色;氯水具有酸性和漂白性;
(4)e处发生2Fe2++Cl2=2Fe3++2Cl-,铁离子遇KSCN溶液为血红色,则e处滤纸的实验现象是血红色,故答案为:血红色;2Fe2++Cl2=2Fe3++2Cl-;
(5)在标准状况下产生56L的氯气,n(Cl2)=$\frac{56L}{22.4L/mol}$=2.5mol,转移电子为2.5mol×2×[0-(-1)]=5mol,故答案为:5mol.
点评 本题考查氧化还原反应计算,为高频考点,把握物质的性质、反应中元素的化合价变化为解答的关键,侧重分析与应用能力的考查,注意反应与现象的关系,题目难度不大.

练习册系列答案
 快乐暑假暑假能力自测中西书局系列答案
快乐暑假暑假能力自测中西书局系列答案
相关题目
12.在一定温度下,密闭容器中可逆反应A(g)+3B(g)?2C(g)达到平衡的标志是( )
| A. | C的反应速率与B的生成速率相等 | |
| B. | 单位时间内生成2n mol A,同时生成3n mol B | |
| C. | A、B、C的浓度不再变化 | |
| D. | A、B、C的浓度之比为1:3:2 |
13.碳酸钠和碳酸氢钠是生活中常见的盐,下列说法错误的是( )
| A. | 可通入过量的CO2气体来除去NaHCO3溶液中少量的Na2CO3杂质 | |
| B. | 可采用滴加少量的澄清石灰水来鉴别Na2CO3和NaHCO3两种白色固体 | |
| C. | 等质量的Na2CO3和NaHCO3分别与足量的盐酸反应,后者放出的CO2多 | |
| D. | 通过称取ag Na2CO3和NaHCO3的混合物经充分加热冷却后恒重bg能够测出混合物中Na2CO3的质量分数 |
10.有关化学用语正确的( )
| A. | NH3的结构式为: | B. | NH4Cl的电子式: | ||
| C. | 乙烯的结构简式:CH2CH2 | D. | -CH3(甲基)的电子式为: |
17.下列物质的名称和主要成分的化学式对应不正确的是( )
| A. | 石膏(CaSO4•2H2O) | B. | 硫铁矿(FeS2) | ||
| C. | 纯碱(NaHCO3) | D. | 芒硝(Na2SO4•10H2O) |
11.正确掌握化学用语是学好化学的基础,下列化学用语正确的是( )
| A. | 苯的分子式为C6H6 | B. | 乙烯的结构简式为CH2CH2 | ||
| C. | 四氯化碳的电子式: | D. | 硫离子结构示意图: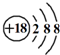 |
12.两种气态烃组成的混合物共0.1mol,完全燃烧后得到4.48L CO2(标准状况)和4.5g水,则这两种气体可能是( )
| A. | CH4和C3H6 | B. | CH4和C2H4 | C. | CH4和C3H8 | D. | CH4和C4H6 |
 前四周期原子序数依次增大的六种元素,A、B、C、D、E、H中,A元素在宇宙中含量最丰富,B元素基态原子的核外有3种能量不同的原子轨道,且每种轨道中的电子数目相同.D元素是地壳中含量最多的元素,E为d区元素,其外围电子排布中有4对成对电子,H元素基态原子最外层只有一个电子,其它层均已充满电子.
前四周期原子序数依次增大的六种元素,A、B、C、D、E、H中,A元素在宇宙中含量最丰富,B元素基态原子的核外有3种能量不同的原子轨道,且每种轨道中的电子数目相同.D元素是地壳中含量最多的元素,E为d区元素,其外围电子排布中有4对成对电子,H元素基态原子最外层只有一个电子,其它层均已充满电子.