题目内容
9.某温度下,在2L密闭容器(恒容)中进行反应2A(g)+B(s)═C(g)+2D(g),开始充入1mol A、3mol B,2s后测得容器内气体压强为原先的1.2倍.前2s用A表示的反应速率及2S 末D的物质的量分别为( )| A. | 0.1 mol•L-1•s-1,0.4 mol | B. | 0.2 mol•L-1•s-1,0.4 mol | ||
| C. | 0.2 mol•L-1•s-1,0.6 mol | D. | 0.4 mol•L-1•s-1,0.12 mol |
分析 恒温恒容时,根据容器内气体的物质的量之比等于压强之比计算反应后气体的物质的量,根据气体增加的物质的量计算生成D的物质的量及A参加反应的物质的量,再根据v=v=$\frac{\frac{△n}{V}}{△t}$计算A的反应速率.
解答 解:恒温恒容时,容器内气体的物质的量之比等于压强之比,反应前气体的物质的量为1mol,反应后气体的物质的量为1.2mol,反应体系增加的气体的物质的量为(1.2-1)mol,
设生成D的物质的量为y,参加反应的A的物质的量为x,
2A(g)+B(s)=C(g)+2D(g) 增加气体的物质的量
2mol 2mol 1mol
x y (1.2-1)mol
x=0.4mol
y=0.4mol
则A的化学反应速率为:v=$\frac{\frac{△n}{V}}{△t}$=$\frac{\frac{0.4mol}{2L}}{2s}$=0.1mol/L•s,2s末D的物质的量为0.4mol,
故选A.
点评 本题考查了化学反应速率与化学计量数的关系,题目难度不大,明确“恒温恒容时,容器内气体的物质的量之比等于压强之比”是解本题的关键,试题培养了学生的分析能力及化学计算能力.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
19.霉酚酸是一种生物活性化合物.下列有关霉酚酸的说法正确的是( )
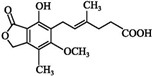

| A. | 分子式为C17H18O6 | B. | 该物质属于脂环化合物 | ||
| C. | 只有两种官能团 | D. | 该物质可发生酯化反应 |
20.下列实验不能获得成功的是( )
①将水和溴乙烷混合加热制乙醇
②将乙醇与浓硫酸共热至140℃来制取乙烯
③用电石和水制取乙炔
④苯、浓溴水和铁粉混合,反应后可制得溴苯
⑤将乙醇和3mol•L -1的硫酸按体积比1:3混和共热至170℃制乙烯.
①将水和溴乙烷混合加热制乙醇
②将乙醇与浓硫酸共热至140℃来制取乙烯
③用电石和水制取乙炔
④苯、浓溴水和铁粉混合,反应后可制得溴苯
⑤将乙醇和3mol•L -1的硫酸按体积比1:3混和共热至170℃制乙烯.
| A. | 只有②④⑤ | B. | 只有①②④ | C. | 只有②④ | D. | 只有①②④⑤ |
17.已知C-C单键可以绕键轴旋转,结构简式为 的烃,下列说法中正确的是( )
的烃,下列说法中正确的是( )
 的烃,下列说法中正确的是( )
的烃,下列说法中正确的是( )| A. | 在 FeBr3的催化作用下可与溴水发生取代反应 | |
| B. | 该烃与足量 H2的加成产物一氯代物最多有四种 | |
| C. | 分子中至少有10个碳原子处于同一平面上 | |
| D. | 该烃是苯的同系物 |
4.下列单质分子中,键长最长,键能最小的是( )
| A. | H2 | B. | Cl2 | C. | Br2 | D. | I2 |
1.现有七种元素,其中A、B、C、D、E为短周期主族元素,F、G为第四周期元素,它们的原子序数依次增大.请根据下列相关信息,回答问题.
(1)已知B2A4是一种无色发烟的、具有腐蚀性和强还原性的无色油状液体,能很好地混溶于水,遇卤素、过氧化氢等强氧化剂作用能自燃.B2A4属于极性分子(填“极性”或“非极性”),B2A4分子中B原子轨道的杂化形式为sp3.写出B2A4的电子式: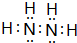 .
.
(2)B元素基态原子中能量最高的电子,其电子云在空间有3个方向,原子轨道呈哑铃形.
(3)某同学根据上述信息,推断C基态原子的核外电子排布图为 该同学所画的电子排布图违背了泡利原理.
该同学所画的电子排布图违背了泡利原理.
(4)分析DE3分子的空间构型为三角锥形.
(5)G位于第Ⅷ族d区,该元素的核外电子排布式为1s22s22p63s23p63d74s2.
(6)无水GE2为深蓝色,吸水后变为粉红色的水合物,水合物受热后又变成无水GE2,故常在实验室中用作吸湿剂和空气湿度指示剂.
GE2+xH2O=GE2•xH2O
深蓝色 粉红色
现有65g无水GE2,吸水后变成GE2•xH2O 119g.
①水合物中x=6.
②若该化合物中Co2+配位数为6,而且经定量测定得知内界和外界占有Cl-的个数比为1:1,则其化学式可表示为[CoCl(H2O)5]Cl•H2O.
| A元素的核外电子数和电子层数相等 |
| B元素原子的核外p电子数比s电子数少1 |
| C原子的第一至第四电离能如下: |
| I1=738kJ•mol-1 I2=1451kJ•mol-1 I3=7733kJ•mol-1 I4=10540kJ•mol-1 |
| D原子核外所有p轨道全满或半满 |
| E元素的主族序数与周期数的差为4 |
| F是前四周期中未成对电子最多的元素 |
| G的3d能级只含有2对成对电子 |
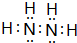 .
.(2)B元素基态原子中能量最高的电子,其电子云在空间有3个方向,原子轨道呈哑铃形.
(3)某同学根据上述信息,推断C基态原子的核外电子排布图为
 该同学所画的电子排布图违背了泡利原理.
该同学所画的电子排布图违背了泡利原理.(4)分析DE3分子的空间构型为三角锥形.
(5)G位于第Ⅷ族d区,该元素的核外电子排布式为1s22s22p63s23p63d74s2.
(6)无水GE2为深蓝色,吸水后变为粉红色的水合物,水合物受热后又变成无水GE2,故常在实验室中用作吸湿剂和空气湿度指示剂.
GE2+xH2O=GE2•xH2O
深蓝色 粉红色
现有65g无水GE2,吸水后变成GE2•xH2O 119g.
①水合物中x=6.
②若该化合物中Co2+配位数为6,而且经定量测定得知内界和外界占有Cl-的个数比为1:1,则其化学式可表示为[CoCl(H2O)5]Cl•H2O.
18.已知某有机物A的红外光谱和核磁共振氢谱如下图所示,下列说法中正确的( )
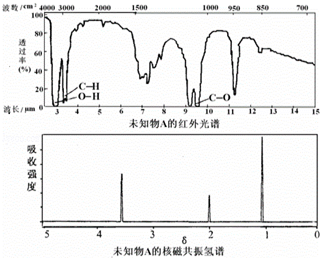

| A. | 由红光外谱可知,该有机物中有三种不同的化学键 | |
| B. | 由核磁共振氢谱可知,该有机物分子中有两种不同化学环境的氢原子 | |
| C. | 仅由核磁共振氢谱即可得知其分子中的氢原子总数 | |
| D. | 若A的化学式为C2H6O,则其结构简式为CH3-O-CH3 |
19.在2L恒容绝热(不与外界交换能量)容器中进行2A(g)+B(g)?2C(g)+D(s)反应,按下表数据投料,反应10s后达到平衡状态,测得体系压强升高,前10s内v(A)=0.025mol/(L•s).下列说法正确的是( )
| 物质 | A | B | C | D |
| 起始投料(mol) | 2 | 1 | 2 | 0 |
| A. | 该反应的△H>0 | B. | 温度升高,该反应的平衡常数减小 | ||
| C. | 到达平衡时,n(B)=0.5 mol | D. | 平衡后,增加D的量,平衡逆向移动 |