题目内容
20.下列实验不能获得成功的是( )①将水和溴乙烷混合加热制乙醇
②将乙醇与浓硫酸共热至140℃来制取乙烯
③用电石和水制取乙炔
④苯、浓溴水和铁粉混合,反应后可制得溴苯
⑤将乙醇和3mol•L -1的硫酸按体积比1:3混和共热至170℃制乙烯.
| A. | 只有②④⑤ | B. | 只有①②④ | C. | 只有②④ | D. | 只有①②④⑤ |
分析 ①溴乙烷和NaOH的水溶液发生水解反应生成乙醇;
②将乙醇与浓硫酸共热至170℃来制取乙烯;
③实验室用电石和水制取乙炔;
④苯和浓溴水不反应,和液溴在溴化铁作催化剂条件下发生取代反应生成溴苯;
⑤将乙醇和浓硫酸按体积比1:3混和共热至170℃制乙烯.
解答 解:①溴乙烷和NaOH的水溶液发生水解反应生成乙醇,溴乙烷和水不反应,所以不能实现实验目的,故错误;
②将乙醇与浓硫酸共热至170℃来制取乙烯,加热140℃得到乙醚,故错误;
③电石的主要成分是碳化钙,碳化钙和水反应生成氢氧化钙和乙炔,所以实验室用电石和水制取乙炔,故正确;
④苯和浓溴水不反应,和液溴在溴化铁作催化剂条件下发生取代反应生成溴苯,所以不能实现实验目的,故错误;
⑤将乙醇和浓硫酸按体积比1:3混和共热至170℃制乙烯,浓硫酸作催化剂,稀硫酸没有催化作用,故错误;
故选D.
点评 本题考查化学实验方案评价,为高频考点,涉及物质制备、实验操作等知识点,明确实验原理、物质性质、实验条件等知识点是解本题关键,注意实验室制取乙烯时温度计位置及加热温度,为易错点.

练习册系列答案
 名师伴你成长课时同步学练测系列答案
名师伴你成长课时同步学练测系列答案
相关题目
4.下列物质中,不能直接用单质反应制得的是( )
| A. | CuCl2 | B. | SO3 | C. | FeCl3 | D. | NO2 |
11.下列事实能判断金属元素甲的金属性一定比乙的金属性强的有( )
①甲单质能与乙的盐溶液反应
②甲、乙两元素原子的最外层电子数相同,且甲的原子半径小于乙的原子半径
③甲、乙两短周期元素原子的电子层数相同,且甲的原子序数小于乙的原子序数
④两单质分别与氯气反应时生成的阳离子,甲失去的电子数比乙失去的电子数多.
①甲单质能与乙的盐溶液反应
②甲、乙两元素原子的最外层电子数相同,且甲的原子半径小于乙的原子半径
③甲、乙两短周期元素原子的电子层数相同,且甲的原子序数小于乙的原子序数
④两单质分别与氯气反应时生成的阳离子,甲失去的电子数比乙失去的电子数多.
| A. | 全部可以 | B. | 仅②不可以 | C. | 仅②④不可以 | D. | 仅③可以 |
8. 香兰素是重要的香料之一,它可由丁香酚经多步反应合成(如图),有关如图两种化合物的说法正确的是( )
香兰素是重要的香料之一,它可由丁香酚经多步反应合成(如图),有关如图两种化合物的说法正确的是( )
 香兰素是重要的香料之一,它可由丁香酚经多步反应合成(如图),有关如图两种化合物的说法正确的是( )
香兰素是重要的香料之一,它可由丁香酚经多步反应合成(如图),有关如图两种化合物的说法正确的是( )| A. | 常温下,1mol丁香酚只能与1mol Br2发生反应 | |
| B. | 香兰素分子中至少有12个原子共平面 | |
| C. | 1mol香兰素最多能与3mol氢气发生加成反应 | |
| D. | 丁香酚不能与FeCl3溶液发生显色反应 |
15.下列结论错误的个数是( )
①微粒半径:r(K+)>r(S2-)
②氢化物的稳定性:HCl>H2S
③还原性:Cl->I-
④氧化性:Cl2>S
⑤酸性:H2SO4>H3PO4
⑥非金属性:O>N
⑦金属性:Mg<Ca.
①微粒半径:r(K+)>r(S2-)
②氢化物的稳定性:HCl>H2S
③还原性:Cl->I-
④氧化性:Cl2>S
⑤酸性:H2SO4>H3PO4
⑥非金属性:O>N
⑦金属性:Mg<Ca.
| A. | 1个 | B. | 2个 | C. | 3个 | D. | 4个 |
5.在四个不同容器中,在不同的条件下进行合成氨的反应:N2+3H2?2NH3,根据在相同时间内测定的结果判断,生成氨的速率最快的是( )
| A. | V(H2)=0.1 mol•L-1•S-1? | B. | V(N2)=0.2 mol•L-1•S-1? | ||
| C. | V(NH3)=0.15 mol•L-1•S-1? | D. | V(H2)=18 mol•L-1•min-1? |
12.下列化学用语的书写,不正确的是( )
| A. | 溴化钠的电子式: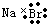 | B. | 硫原子的结构示意图: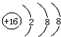 | ||
| C. | 氢气分子的电子式: | D. | 水的分子式为H2O |
9.某温度下,在2L密闭容器(恒容)中进行反应2A(g)+B(s)═C(g)+2D(g),开始充入1mol A、3mol B,2s后测得容器内气体压强为原先的1.2倍.前2s用A表示的反应速率及2S 末D的物质的量分别为( )
| A. | 0.1 mol•L-1•s-1,0.4 mol | B. | 0.2 mol•L-1•s-1,0.4 mol | ||
| C. | 0.2 mol•L-1•s-1,0.6 mol | D. | 0.4 mol•L-1•s-1,0.12 mol |
10.某实验小组用工业上废渣(主要成分Cu2S和Fe2O3)制取纯铜和绿矾(FeSO4•7H2O)产品,设计流程如图1:
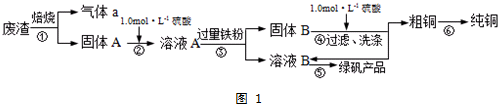
(1)在实验室中,欲用98%的浓硫酸(密度为1.84g•mL-1)配制500mL1.0mol•L-1的硫酸,需要的仪器除量筒、烧杯、玻璃棒外,还有胶头滴管、500mL容量瓶.
(2)该小组同学设计如图2装置模拟废渣在过量氧气中焙烧,并验证废渣中含硫元素.
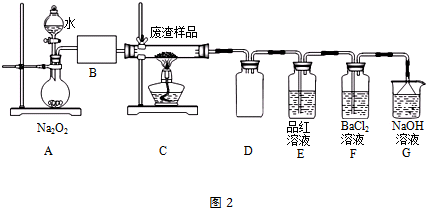
①装置A中反应的化学方程式为2Na2O2+2H2O=4NaOH+O2↑;为控制反应不过于激烈并产生平稳气流,采取的操作是打开分液漏斗上口瓶塞,控制分液漏斗旋塞,使水匀速逐滴滴下;B处应连接盛有碱石灰的干燥管(或U形管)或浓硫酸的洗气瓶(填写试剂及仪器名称).
②E装置中加入品红溶液的目的是检验气体a中的SO2;当F装置中出现白色沉淀时,反应离子方程式为2SO2+O2+2H2O+2Ba2+=2BaSO4↓+4H+.
(3)步骤⑥中由粗铜得到纯铜的方法为电解精炼(填写名称).
(4)为测定产品中绿矾的质量分数,称取30.000g样品溶于水配成250mL溶液,取25.00mL溶液于锥形瓶中,用0.1000mol•L-1酸性KMnO4溶液进行滴定,反应为:10FeSO4+8H2SO4+2KMnO4=2MnSO4+5Fe2(SO4)3+K2SO4+8H2O.实验所得数据如表所示:
①第1组实验数据出现异常,造成这种异常的原因可能是ad(填代号).
a.酸式滴定管用蒸馏水洗净后未用标准液润洗
b.锥形瓶洗净后未干燥
c.滴定终点时俯视读数
d.滴定终点时仰视读数
②根据表中数据,计算所得产品中绿矾的质量分数为92.7%.(保留三位有效数字)

(1)在实验室中,欲用98%的浓硫酸(密度为1.84g•mL-1)配制500mL1.0mol•L-1的硫酸,需要的仪器除量筒、烧杯、玻璃棒外,还有胶头滴管、500mL容量瓶.
(2)该小组同学设计如图2装置模拟废渣在过量氧气中焙烧,并验证废渣中含硫元素.

①装置A中反应的化学方程式为2Na2O2+2H2O=4NaOH+O2↑;为控制反应不过于激烈并产生平稳气流,采取的操作是打开分液漏斗上口瓶塞,控制分液漏斗旋塞,使水匀速逐滴滴下;B处应连接盛有碱石灰的干燥管(或U形管)或浓硫酸的洗气瓶(填写试剂及仪器名称).
②E装置中加入品红溶液的目的是检验气体a中的SO2;当F装置中出现白色沉淀时,反应离子方程式为2SO2+O2+2H2O+2Ba2+=2BaSO4↓+4H+.
(3)步骤⑥中由粗铜得到纯铜的方法为电解精炼(填写名称).
(4)为测定产品中绿矾的质量分数,称取30.000g样品溶于水配成250mL溶液,取25.00mL溶液于锥形瓶中,用0.1000mol•L-1酸性KMnO4溶液进行滴定,反应为:10FeSO4+8H2SO4+2KMnO4=2MnSO4+5Fe2(SO4)3+K2SO4+8H2O.实验所得数据如表所示:
| 滴定次数 | 1 | 2 | 3 | 4 |
| KMnO4溶液体积/mL | 20.90 | 20.02 | 19.98 | 20.00 |
a.酸式滴定管用蒸馏水洗净后未用标准液润洗
b.锥形瓶洗净后未干燥
c.滴定终点时俯视读数
d.滴定终点时仰视读数
②根据表中数据,计算所得产品中绿矾的质量分数为92.7%.(保留三位有效数字)