题目内容
1.现有七种元素,其中A、B、C、D、E为短周期主族元素,F、G为第四周期元素,它们的原子序数依次增大.请根据下列相关信息,回答问题.| A元素的核外电子数和电子层数相等 |
| B元素原子的核外p电子数比s电子数少1 |
| C原子的第一至第四电离能如下: |
| I1=738kJ•mol-1 I2=1451kJ•mol-1 I3=7733kJ•mol-1 I4=10540kJ•mol-1 |
| D原子核外所有p轨道全满或半满 |
| E元素的主族序数与周期数的差为4 |
| F是前四周期中未成对电子最多的元素 |
| G的3d能级只含有2对成对电子 |
 .
.(2)B元素基态原子中能量最高的电子,其电子云在空间有3个方向,原子轨道呈哑铃形.
(3)某同学根据上述信息,推断C基态原子的核外电子排布图为
 该同学所画的电子排布图违背了泡利原理.
该同学所画的电子排布图违背了泡利原理.(4)分析DE3分子的空间构型为三角锥形.
(5)G位于第Ⅷ族d区,该元素的核外电子排布式为1s22s22p63s23p63d74s2.
(6)无水GE2为深蓝色,吸水后变为粉红色的水合物,水合物受热后又变成无水GE2,故常在实验室中用作吸湿剂和空气湿度指示剂.
GE2+xH2O=GE2•xH2O
深蓝色 粉红色
现有65g无水GE2,吸水后变成GE2•xH2O 119g.
①水合物中x=6.
②若该化合物中Co2+配位数为6,而且经定量测定得知内界和外界占有Cl-的个数比为1:1,则其化学式可表示为[CoCl(H2O)5]Cl•H2O.
分析 A、B、C、D、E为短周期主族元素,F、G为第四周期元素,它们的原子序数依次增大.A元素的核外电子数和电子层数相等,则A为H元素;B元素原子的核外p电子数比s电子数少1,原子核外电子排布为1s22s22p3,故B为N元素;由C原子的第一至第四电离能数据可知,第三电离能剧增,故C表现+2价,处于ⅡA族,原子序数大于N元素,故C为Mg元素;D处于第三周期,D原子价电子层的p轨道半满,价电子排布式为3s23p3,故D为P元素;E也处于第三周期,E元素的主族序数与周期数的差为4,E处于第ⅦA族,故E为Cl元素;F是前四周期中未成对电子最多的元素,F为第四周期元素,外围电子排布为3d54s1,故F为Cr;G的3d能级只含有2对成对电子,外围电子排布为3d74s2,故G为Co.
解答 解:A、B、C、D、E为短周期主族元素,F、G为第四周期元素,它们的原子序数依次增大.A元素的核外电子数和电子层数相等,则A为H元素;B元素原子的核外p电子数比s电子数少1,原子核外电子排布为1s22s22p3,故B为N元素;由C原子的第一至第四电离能数据可知,第三电离能剧增,故C表现+2价,处于ⅡA族,原子序数大于N元素,故C为Mg元素;D处于第三周期,D原子价电子层的p轨道半满,价电子排布式为3s23p3,故D为P元素;E也处于第三周期,E元素的主族序数与周期数的差为4,E处于第ⅦA族,故E为Cl元素;F是前四周期中未成对电子最多的元素,F为第四周期元素,外围电子排布为3d54s1,故F为Cr;G的3d能级只含有2对成对电子,外围电子排布为3d74s2,故G为Co.
(1)N2H4分子中N原子形成3个键,含有去对孤对电子,N原子采取sp3杂化,为展开书页形结构,属于极性分子,N2H4的电子式: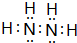 ,
,
故答案为:极性;sp3;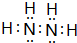 ;
;
(2)B为N元素,核外电子排布式为1s22s22p3,基态原子中能量最高的电子处于2p能级,有3个电子,其电子云在空间有3个方向,原子轨道呈哑铃形,
故答案为:3;哑铃;
(3)某同学根据上述信息,推断C基态原子的核外电子排布为 ,该同学所画的电子排布图中3s能级中2个电子自旋方向相同,违背了泡利原理,
,该同学所画的电子排布图中3s能级中2个电子自旋方向相同,违背了泡利原理,
故答案为:泡利原理;
(4)PCl3分子中P原子形成3个键,含有1对孤对电子,价层电子对数为4,空间构型为三角锥形,
故答案为:三角锥形;
(5)G的3d能级只含有2对成对电子,核外电子排布为1s22s22p63s23p63d74s2,处于第四周期第Ⅷ族,属于d区元素,原子核外电子排布为,
故答案为:1s22s22p63s23p63d74s2;第Ⅷ;d;
(6)①xH2O+CoCl2=CoCl2•xH2O△m
131+18x 18x
119g (119-65)g
所以(131+18x):18x=119g:(119-65)g,
解得:x=6;
故答案为:6;
②该化合物CoCl2•6H2O中Co2+配位数为6,而且经定量测定得知配体和外界各占有Cl-个数为1:1,即各有1个氯离子,则内界中含有1个氯离子和5个水分子;外界有1个氯离子,另外还有1个结晶水,所以化学式可表示为:[CoCl(H2O)5]Cl•H2O,
故答案为:[CoCl(H2O)5]Cl•H2O.
点评 本题是对物质结构与性质的考查,涉及核外电子排布规律、杂化方式与空间构型判断、元素周期表、配合物等,题目比较综合,难度中等,推断元素是解题的关键,注意基础知识的掌握.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案①甲单质能与乙的盐溶液反应
②甲、乙两元素原子的最外层电子数相同,且甲的原子半径小于乙的原子半径
③甲、乙两短周期元素原子的电子层数相同,且甲的原子序数小于乙的原子序数
④两单质分别与氯气反应时生成的阳离子,甲失去的电子数比乙失去的电子数多.
| A. | 全部可以 | B. | 仅②不可以 | C. | 仅②④不可以 | D. | 仅③可以 |
| A. | 溴化钠的电子式: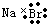 | B. | 硫原子的结构示意图: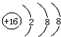 | ||
| C. | 氢气分子的电子式: | D. | 水的分子式为H2O |
| A. | 0.1 mol•L-1•s-1,0.4 mol | B. | 0.2 mol•L-1•s-1,0.4 mol | ||
| C. | 0.2 mol•L-1•s-1,0.6 mol | D. | 0.4 mol•L-1•s-1,0.12 mol |
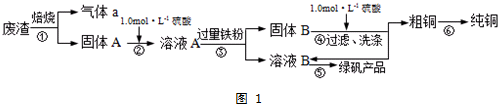
(1)在实验室中,欲用98%的浓硫酸(密度为1.84g•mL-1)配制500mL1.0mol•L-1的硫酸,需要的仪器除量筒、烧杯、玻璃棒外,还有胶头滴管、500mL容量瓶.
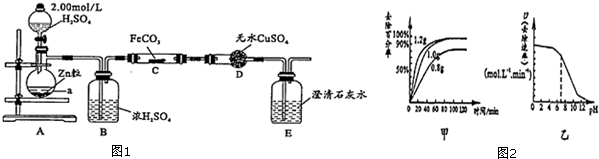
(2)该小组同学设计如图2装置模拟废渣在过量氧气中焙烧,并验证废渣中含硫元素.
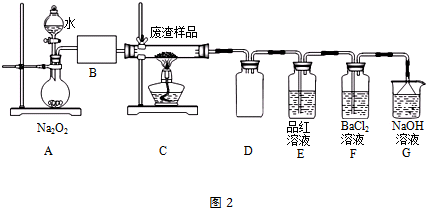
①装置A中反应的化学方程式为2Na2O2+2H2O=4NaOH+O2↑;为控制反应不过于激烈并产生平稳气流,采取的操作是打开分液漏斗上口瓶塞,控制分液漏斗旋塞,使水匀速逐滴滴下;B处应连接盛有碱石灰的干燥管(或U形管)或浓硫酸的洗气瓶(填写试剂及仪器名称).
②E装置中加入品红溶液的目的是检验气体a中的SO2;当F装置中出现白色沉淀时,反应离子方程式为2SO2+O2+2H2O+2Ba2+=2BaSO4↓+4H+.
(3)步骤⑥中由粗铜得到纯铜的方法为电解精炼(填写名称).
(4)为测定产品中绿矾的质量分数,称取30.000g样品溶于水配成250mL溶液,取25.00mL溶液于锥形瓶中,用0.1000mol•L-1酸性KMnO4溶液进行滴定,反应为:10FeSO4+8H2SO4+2KMnO4=2MnSO4+5Fe2(SO4)3+K2SO4+8H2O.实验所得数据如表所示:
| 滴定次数 | 1 | 2 | 3 | 4 |
| KMnO4溶液体积/mL | 20.90 | 20.02 | 19.98 | 20.00 |
a.酸式滴定管用蒸馏水洗净后未用标准液润洗
b.锥形瓶洗净后未干燥
c.滴定终点时俯视读数
d.滴定终点时仰视读数
②根据表中数据,计算所得产品中绿矾的质量分数为92.7%.(保留三位有效数字)
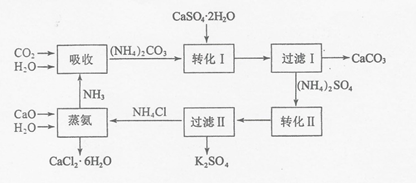
请回答以下问题:
(1)为了提高原料的利用率,吸收流程中通入CO2和NH3的先后顺序最好为先通入NH3,后通入CO2.
(2)碳酸铵溶液与磷石膏悬浊溶液混合后发生转化I的离子反应方程式为CaSO4+CO32-?CaCO3+SO42.
(3)工艺流程中除了所给出的CaCO3、CaSO4•2H2O、NH3、H2O等原料外,在转化Ⅱ的过程中还需要加入KCl原料.
(4)①过滤Ⅱ后所得滤液NH4Cl溶液,确认其中含有Cl-的方法是:取滤液少量与试管中,滴加足量的硝酸钡或氢氧化钡至无沉淀生成,静置后取上层清夜少量与另一支试管中,滴加稀硝酸至溶液呈酸性后,再滴加硝酸银溶液,如果有白色沉淀生成,即可证明原滤液中含有氯离子;
②氯化钙结晶水合物(CaCl2•6H2O)是目前常用的无机储热材料,选择的依据是因为ad(选填序号);
A.熔点较低(29℃熔化) b.能导电 c.能制冷 d.无毒
③已知不同温度下K2SO4在100g水中达到饱和时溶解的量如下表:
| 温度(℃) | 0 | 20 | 60 |
| K2SO4溶解的量(g) | 7.4 | 11.1 | 18.2 |
(5)上述工艺流程中循环利用的物质是NH3;还有一种物质,只要其纯净,也可以被循环利用,它是CaCO3(均填化学式).