题目内容
19.在2L恒容绝热(不与外界交换能量)容器中进行2A(g)+B(g)?2C(g)+D(s)反应,按下表数据投料,反应10s后达到平衡状态,测得体系压强升高,前10s内v(A)=0.025mol/(L•s).下列说法正确的是( )| 物质 | A | B | C | D |
| 起始投料(mol) | 2 | 1 | 2 | 0 |
| A. | 该反应的△H>0 | B. | 温度升高,该反应的平衡常数减小 | ||
| C. | 到达平衡时,n(B)=0.5 mol | D. | 平衡后,增加D的量,平衡逆向移动 |
分析 由起始D的物质的量为0可知,反应2A (g)+B(g)?2C(g)+D(s)向正反应进行建立平衡,正反应是气体体积减小的反应,容器的体积不变,而平衡时压强增大,说明在绝热条件下,混合气体的温度升高了,从而证明正反应为放热反应,其焓变△H<0,据此结合影响化学平衡的因素进行解答.
解答 解:起始时D的物质的量为0,则反应2A (g)+B(g)?2C(g)+D(s)只能向正反应进行建立平衡,正反应是气体体积减小的反应,又容器的体积不变,而平衡时压强增大,说明在绝热条件下,混合气体的温度升高了,则哎反应的正反应为放热反应,
A.根据分析可知,该反应为放热反应,则△H<0,故A错误;
B.该反应为放热反应,升高温度后平衡向着逆向移动,则该反应的平衡常数会减小,故B正确;
C.前10s内v(A)=0.025mol/(L•s),则前10s内v(B)=0.0125mol/(L•s),平衡时消耗B的物质的量为:0.0125mol/(L•s)×10s×2L=0.25mol,所以平衡时B的物质的量为:1mol-0.25mol=0.75mol,故C错误;
D.D为固体,平衡时增加D,平衡不发生移动,故D错误;
故选B.
点评 本题考查了化学平衡及其影响因素,题目难度中等,根据题干数据正确判断该反应为放热反应为解答关键,注意熟练掌握影响化学平衡的因素,试题培养了学生的分析能力及灵活应用能力.

练习册系列答案
相关题目
9.某温度下,在2L密闭容器(恒容)中进行反应2A(g)+B(s)═C(g)+2D(g),开始充入1mol A、3mol B,2s后测得容器内气体压强为原先的1.2倍.前2s用A表示的反应速率及2S 末D的物质的量分别为( )
| A. | 0.1 mol•L-1•s-1,0.4 mol | B. | 0.2 mol•L-1•s-1,0.4 mol | ||
| C. | 0.2 mol•L-1•s-1,0.6 mol | D. | 0.4 mol•L-1•s-1,0.12 mol |
10.某实验小组用工业上废渣(主要成分Cu2S和Fe2O3)制取纯铜和绿矾(FeSO4•7H2O)产品,设计流程如图1:
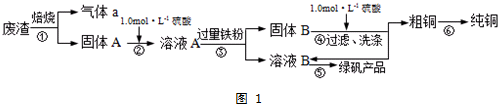
(1)在实验室中,欲用98%的浓硫酸(密度为1.84g•mL-1)配制500mL1.0mol•L-1的硫酸,需要的仪器除量筒、烧杯、玻璃棒外,还有胶头滴管、500mL容量瓶.
(2)该小组同学设计如图2装置模拟废渣在过量氧气中焙烧,并验证废渣中含硫元素.
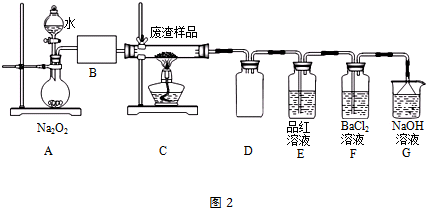
①装置A中反应的化学方程式为2Na2O2+2H2O=4NaOH+O2↑;为控制反应不过于激烈并产生平稳气流,采取的操作是打开分液漏斗上口瓶塞,控制分液漏斗旋塞,使水匀速逐滴滴下;B处应连接盛有碱石灰的干燥管(或U形管)或浓硫酸的洗气瓶(填写试剂及仪器名称).
②E装置中加入品红溶液的目的是检验气体a中的SO2;当F装置中出现白色沉淀时,反应离子方程式为2SO2+O2+2H2O+2Ba2+=2BaSO4↓+4H+.
(3)步骤⑥中由粗铜得到纯铜的方法为电解精炼(填写名称).
(4)为测定产品中绿矾的质量分数,称取30.000g样品溶于水配成250mL溶液,取25.00mL溶液于锥形瓶中,用0.1000mol•L-1酸性KMnO4溶液进行滴定,反应为:10FeSO4+8H2SO4+2KMnO4=2MnSO4+5Fe2(SO4)3+K2SO4+8H2O.实验所得数据如表所示:
①第1组实验数据出现异常,造成这种异常的原因可能是ad(填代号).
a.酸式滴定管用蒸馏水洗净后未用标准液润洗
b.锥形瓶洗净后未干燥
c.滴定终点时俯视读数
d.滴定终点时仰视读数
②根据表中数据,计算所得产品中绿矾的质量分数为92.7%.(保留三位有效数字)

(1)在实验室中,欲用98%的浓硫酸(密度为1.84g•mL-1)配制500mL1.0mol•L-1的硫酸,需要的仪器除量筒、烧杯、玻璃棒外,还有胶头滴管、500mL容量瓶.
(2)该小组同学设计如图2装置模拟废渣在过量氧气中焙烧,并验证废渣中含硫元素.

①装置A中反应的化学方程式为2Na2O2+2H2O=4NaOH+O2↑;为控制反应不过于激烈并产生平稳气流,采取的操作是打开分液漏斗上口瓶塞,控制分液漏斗旋塞,使水匀速逐滴滴下;B处应连接盛有碱石灰的干燥管(或U形管)或浓硫酸的洗气瓶(填写试剂及仪器名称).
②E装置中加入品红溶液的目的是检验气体a中的SO2;当F装置中出现白色沉淀时,反应离子方程式为2SO2+O2+2H2O+2Ba2+=2BaSO4↓+4H+.
(3)步骤⑥中由粗铜得到纯铜的方法为电解精炼(填写名称).
(4)为测定产品中绿矾的质量分数,称取30.000g样品溶于水配成250mL溶液,取25.00mL溶液于锥形瓶中,用0.1000mol•L-1酸性KMnO4溶液进行滴定,反应为:10FeSO4+8H2SO4+2KMnO4=2MnSO4+5Fe2(SO4)3+K2SO4+8H2O.实验所得数据如表所示:
| 滴定次数 | 1 | 2 | 3 | 4 |
| KMnO4溶液体积/mL | 20.90 | 20.02 | 19.98 | 20.00 |
a.酸式滴定管用蒸馏水洗净后未用标准液润洗
b.锥形瓶洗净后未干燥
c.滴定终点时俯视读数
d.滴定终点时仰视读数
②根据表中数据,计算所得产品中绿矾的质量分数为92.7%.(保留三位有效数字)
7.根据元素周期律和物质结构的有关知识,以下有关排序错误的是( )
| A. | 离子半径:S2->Cl->Ca2+ | B. | 电负性:C>N>O | ||
| C. | 热稳定性:HF>H2O>H2S | D. | 酸性:HCl<HBr<HI |
14.NA为阿伏加罗常数的值,下列叙述正确的是( )
| A. | 1molCH3+中含有的电子数为10NA | |
| B. | 1mol铁粉与1mol水蒸气充分反应转移的电子数为3A | |
| C. | 0.1mol/L的Al2(SO4)3溶液中,Al3+的数目小于0.2NA | |
| D. | 电解精炼铜时,若转移了NA个电子,则阴极析出32g铜 |
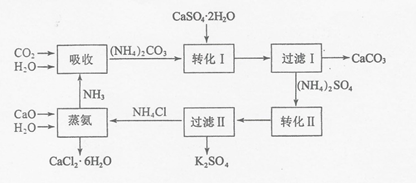
11.磷石膏是磷氨厂生产硫酸和磷酸所排放的废渣(主要成分为CaSO4•2H2O),大量堆积既占用土地,又易造成环境污染和硫资源的浪费,所以可从资源综合利用的角度将磷石膏转化成硫酸钾和氯化钙晶体,工艺流程如下:
请回答以下问题:
(1)为了提高原料的利用率,吸收流程中通入CO2和NH3的先后顺序最好为先通入NH3,后通入CO2.
(2)碳酸铵溶液与磷石膏悬浊溶液混合后发生转化I的离子反应方程式为CaSO4+CO32-?CaCO3+SO42.
(3)工艺流程中除了所给出的CaCO3、CaSO4•2H2O、NH3、H2O等原料外,在转化Ⅱ的过程中还需要加入KCl原料.
(4)①过滤Ⅱ后所得滤液NH4Cl溶液,确认其中含有Cl-的方法是:取滤液少量与试管中,滴加足量的硝酸钡或氢氧化钡至无沉淀生成,静置后取上层清夜少量与另一支试管中,滴加稀硝酸至溶液呈酸性后,再滴加硝酸银溶液,如果有白色沉淀生成,即可证明原滤液中含有氯离子;
②氯化钙结晶水合物(CaCl2•6H2O)是目前常用的无机储热材料,选择的依据是因为ad(选填序号);
A.熔点较低(29℃熔化) b.能导电 c.能制冷 d.无毒
③已知不同温度下K2SO4在100g水中达到饱和时溶解的量如下表:
60℃时K2SO4的饱和溶液945.6g冷却到0℃,可析出K2SO4晶体86.4g.
(5)上述工艺流程中循环利用的物质是NH3;还有一种物质,只要其纯净,也可以被循环利用,它是CaCO3(均填化学式).

请回答以下问题:
(1)为了提高原料的利用率,吸收流程中通入CO2和NH3的先后顺序最好为先通入NH3,后通入CO2.
(2)碳酸铵溶液与磷石膏悬浊溶液混合后发生转化I的离子反应方程式为CaSO4+CO32-?CaCO3+SO42.
(3)工艺流程中除了所给出的CaCO3、CaSO4•2H2O、NH3、H2O等原料外,在转化Ⅱ的过程中还需要加入KCl原料.
(4)①过滤Ⅱ后所得滤液NH4Cl溶液,确认其中含有Cl-的方法是:取滤液少量与试管中,滴加足量的硝酸钡或氢氧化钡至无沉淀生成,静置后取上层清夜少量与另一支试管中,滴加稀硝酸至溶液呈酸性后,再滴加硝酸银溶液,如果有白色沉淀生成,即可证明原滤液中含有氯离子;
②氯化钙结晶水合物(CaCl2•6H2O)是目前常用的无机储热材料,选择的依据是因为ad(选填序号);
A.熔点较低(29℃熔化) b.能导电 c.能制冷 d.无毒
③已知不同温度下K2SO4在100g水中达到饱和时溶解的量如下表:
| 温度(℃) | 0 | 20 | 60 |
| K2SO4溶解的量(g) | 7.4 | 11.1 | 18.2 |
(5)上述工艺流程中循环利用的物质是NH3;还有一种物质,只要其纯净,也可以被循环利用,它是CaCO3(均填化学式).
8. Fenton法常用于处理含难降解有机物的工业废水,通常是在调节好pH和Fe2+浓度的废水中加入H2O2,所产生的羟基自由基能氧化降解污染物.现运用该方法降解有机污染物p-CP,探究有关因素对该降解反应速率的影响.
Fenton法常用于处理含难降解有机物的工业废水,通常是在调节好pH和Fe2+浓度的废水中加入H2O2,所产生的羟基自由基能氧化降解污染物.现运用该方法降解有机污染物p-CP,探究有关因素对该降解反应速率的影响.
[实验设计]控制p-CP的初始浓度相同,恒定实验温度在298K或313K(其余实验条件见下表),设计如下对比实验.
(1)请完成实验设计表中横线上的内容.
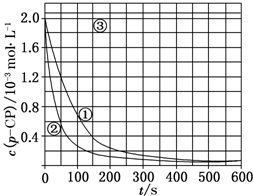
[数据处理]实验测得p-CP的浓度随时间变化的关系如图.
(2)根据上图实验①曲线,计算降解反应50~150s内的反应速率:v(p-CP)=8.0×10-6mol•L-1•s-1.(3)实验①、②表明温度升高,降解反应速率增大.但温度过高时反而导致降解反应速率减小,请从Fenton法所用试剂H2O2的角度分析原因:H2O2在温度过高时迅速分解.
(4)实验时需在不同时间从反应器中取样,并使所取样品中的反应立即停止下来.根据上图中的信息,给出一种迅速停止反应的方法:在溶液中加入碱溶液,使溶液的pH大于或等于10.
 Fenton法常用于处理含难降解有机物的工业废水,通常是在调节好pH和Fe2+浓度的废水中加入H2O2,所产生的羟基自由基能氧化降解污染物.现运用该方法降解有机污染物p-CP,探究有关因素对该降解反应速率的影响.
Fenton法常用于处理含难降解有机物的工业废水,通常是在调节好pH和Fe2+浓度的废水中加入H2O2,所产生的羟基自由基能氧化降解污染物.现运用该方法降解有机污染物p-CP,探究有关因素对该降解反应速率的影响.[实验设计]控制p-CP的初始浓度相同,恒定实验温度在298K或313K(其余实验条件见下表),设计如下对比实验.
(1)请完成实验设计表中横线上的内容.
| 实验编号 | 实验目的 | T/K | pH | c/10-3 mol•L-1 | |
| H2O2 | Fe2+ | ||||
| ① | 为以下实验作参照 | 298 | 3 | 6.0 | 0.30 |
| ② | 探究温度对降解反应速率的影响 | 313 | |||
| ③ | 探究溶液的pH对降解反应速率的影响 | 298 | 10 | 6.0 | 0.30 |
(2)根据上图实验①曲线,计算降解反应50~150s内的反应速率:v(p-CP)=8.0×10-6mol•L-1•s-1.(3)实验①、②表明温度升高,降解反应速率增大.但温度过高时反而导致降解反应速率减小,请从Fenton法所用试剂H2O2的角度分析原因:H2O2在温度过高时迅速分解.
(4)实验时需在不同时间从反应器中取样,并使所取样品中的反应立即停止下来.根据上图中的信息,给出一种迅速停止反应的方法:在溶液中加入碱溶液,使溶液的pH大于或等于10.
 A、B、C、D、E、F、G七种前四周期元素且原子序数依次增大,A的最高正价和最低负价的绝对值相等,B的基态原子有3个不同的能级且各能级中电子数相等,D的基态原子与B的基态原子的未成对电子数目相同,E的基态原子s能级的电子总数与p能级的电子数相等,F的基态原子的3d轨道电子数是4s电子数的4倍,G2+的3d轨道有9个电子,请回答下列问题:
A、B、C、D、E、F、G七种前四周期元素且原子序数依次增大,A的最高正价和最低负价的绝对值相等,B的基态原子有3个不同的能级且各能级中电子数相等,D的基态原子与B的基态原子的未成对电子数目相同,E的基态原子s能级的电子总数与p能级的电子数相等,F的基态原子的3d轨道电子数是4s电子数的4倍,G2+的3d轨道有9个电子,请回答下列问题: