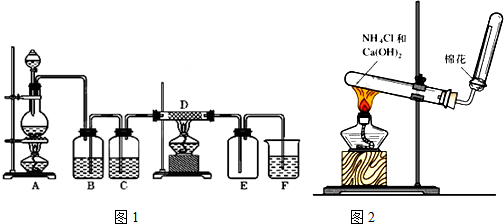
题目内容
14.实验室用乙酸和正丁醇制备乙酸正丁醇,其反应方程式为CH3COOH+CH3CH3CH2CH2OH $\stackrel{浓硫酸}{?}$CH3COOCH2CH2CH2CH3+H2O有关物质的相关数据和信息如下:| 化合物 | 相对分子质量 | 密度/g•cm-3 | 沸点/℃ | 溶解度/(g/100g水) |
| 正丁醇 | 74 | 0.80 | 118.0 | 9 |
| 冰醋酸 | 60 | 1.045 | 118.1 | 互溶 |
| 乙酸正丁酯 | 116 | 0.882 | 126.1 | 0.7 |
(2)醇可发生分子内脱水生成烯烃,如C2H5OH$?_{170℃}^{浓硫酸}$CH2═CH2↑+H2O
请回答有关问题
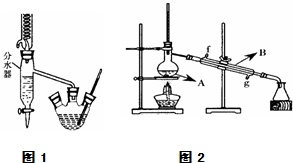
Ⅰ.乙酸正丁酯粗产品的制备
在三孔圆底烧瓶中装入沸石,加入18.5mL正丁醇和15.4mL冰醋酸(稍过量),再加3~4滴浓硫酸.然后安装分水器(作用:实验过程中不断分离除去反应生成的水)、温度计及回流冷凝管,加热冷凝回流反应.
(1)三孔烧瓶和蒸馏烧瓶在加热时都需要加入沸石,加入沸石是作用是防暴沸.本实验过程中可能产生多种有机副产品,请写成其中一种的结构简式CH3CH2CH2CH2OCH2CH2CH2CH3或CH2=CHCH2CH3.
(2)反应时加热有利于提高酯的产率,但实验发现温度过高酯的产率反而降低,可能的原因是乙酸、正丁醇都易挥发,温度过高可能使乙酸、正丁醇大量挥发使产率降低,温度过高可能发生副反应使产率降低.
Ⅱ.乙酸正丁酯粗产品的精制.
(3)将三孔圆底烧瓶中的产物转入分液漏斗中,并用饱和Na2CO3溶液洗涤有机层,接下来进行的操作名称是分液.
(4)将酯层采用如图2所示装置蒸馏.
①图2中仪器B的名称为冷凝管,水的流向应该从g(“f”或“g”)口进入.
②蒸馏收集乙酸正丁酯粗产品时,应将温度控制在126.1℃左右.
分析 I.(1)沸石有防止液体暴沸作用;醇在一定条件下能发生分子内或分子间脱水生成烯烃或醚;
(2)温度过高会促进乙酸、丁醇挥发,还可能发生副反应;
II.(3)将圆底烧瓶中的液体转入分液漏斗中,并用饱和Na2CO3溶液洗涤有机层,除去乙酸、丁醇且降低酯的溶解度,然后进行分液;
(4)①B仪器名称是冷凝管,水应该采用逆流方向;
②收集酯,温度应该控制在酯的沸点左右.
解答 解:I.(1)沸石有防止液体暴沸作用,防止安全事故发生;醇在一定条件下能发生分子内或分子间脱水生成烯烃或醚该条件下,正丁醇能发生分子间脱水形成醚CH3CH2CH2CH2OCH2CH2CH2CH3,也能形成分子内脱水生成正丁烯CH2=CHCH2CH3;
故答案为:防暴沸;CH3CH2CH2CH2OCH2CH2CH2CH3或CH2=CHCH2CH3;
(2)温实验发现温度过高,乙酸正丁酯的产率反而降低,是由于乙酸、正丁醇都易挥发,使产率降低,或因温度过高可能发生副反应使产率降低,如正丁醇在140℃,在浓硫酸催化下发生分子间脱水形成醚CH3CH2CH2CH2OCH2CH2CH2CH3,
故答案为:乙酸、正丁醇都易挥发,温度过高可能使乙酸、正丁醇大量挥发使产率降低,温度过高可能发生副反应使产率降低;
II.(3)将圆底烧瓶中的液体转入分液漏斗中,并用饱和Na2CO3溶液洗涤有机层,乙酸和碳酸钠反应生成乙酸钠、丁醇易溶于饱和碳酸钠溶液,乙酸丁酯在饱和碳酸钠溶液中溶解度小于水中,所以饱和碳酸钠溶液作用是除去乙酸、丁醇、降低酯的溶解度,然后再进行分液得到酯,
故答案为:分液漏斗;分液;
(4)①B仪器名称是冷凝管,水应该采用逆流方向,所以g是进水口、f是出水口,防止蒸气急剧冷却而炸裂冷凝管,故答案为:冷凝管;g;
②乙酸正丁酯的沸点为126.1℃,所以蒸馏收集乙酸正丁酯产品时,应将温度控制在126.1℃左右,
故答案为:126.1℃.
点评 本题考查有机物制备,为高频考点,侧重考查学生实验基本操作及对实验原理的理解和掌握,明确实验原理及物质性质是解本题关键,知道常见仪器及其使用方法,题目难度不大.

(1)请完成以下实验设计表,并在实验目的一栏中填出对应的实验编号:
| 实验 编号 | T/K | 催化剂的用量/g | 酸性KMnO4溶液的浓度/mol•L-1 | 实验目的 |
| ① | 298 | 0.5 | 0.010 | a.实验①和②探究酸性KMnO4溶液的浓度对该反应速率的影响; b.实验①和③探究温度对该反应速率的影响; c.实验①和④探究催化剂对该反应速率的影响. |
| ② | 298 | 0.5 | 0.0010 | |
| ③ | 323 | 0.5 | 0.010 | |
| ④ | 298 | 0 | 0.010 |
| 实验编号 | 溶液褪色所需时间 t/min | ||
| 第1次 | 第2次 | 第3次 | |
| ① | 14.0 | 13.0 | 11.0 |
| ② | 6.0 | 7.0 | 7.0 |
②该同学分析上述数据后得出“当其他条件相同的情况下,酸性KMnO4溶液的浓度越小,所需要的时间就越短,亦即其反应速率越快”的结论,你认为是否正确否(填“是”或“否”).他认为不用经过计算,直接根据表中褪色时间的长短就可以判断浓度大小与反应速率的关系,你认为是否可行否(填“是”或“否”),若不可行(若认为可行则不填),请设计可以直接通过观察褪色时间的长短来判断的改进方案:取过量的体积相同、浓度不同的草酸溶液,分别同时与体积相同、浓度相同的酸性高锰酸钾溶液反应.
| A. | 常温下0.1 mol•L-1的下列溶液中:①NH4Al(SO4)2、②NH4Cl、③CH3COONH4,c(NH4+) 由大到小的顺序为②>①>③ | |
| B. | 常温下0.4 mol•L-1CH3COOH溶液和0.2 mol•L-1 NaOH溶液等体积混合后溶液显酸性,则溶液中粒子浓度由大到小的顺序为c(CH3COO-)>c(Na+)>c(CH3COOH)>c(H+)>c(OH-) | |
| C. | 0.1 mol•L-1 Na2CO3溶液与0.2 mol•L-1 NaHCO3溶液等体积混合所得溶液中:c(CO32-)+2c(OH-)=c(HCO3-)+3c(H2CO3)+2c(H+) | |
| D. | 0.1 mol•L-1的氨水与0.05 mol•L-1 H2C2O4溶液等体积混合所得溶液中:c(NH4+)+c(NH3•H2O)=2c(C2O42-)+2c(HC2O4-)+2c(H2C2O4) |
 Ⅰ
Ⅰ CH=CH2)与丙烯的共聚物是一种高分子阻燃剂,具有低毒、热稳定性好等优点.
CH=CH2)与丙烯的共聚物是一种高分子阻燃剂,具有低毒、热稳定性好等优点. 或
或
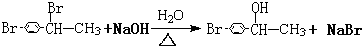 .
. .
. ,1molB完全燃烧时耗氧9mol
,1molB完全燃烧时耗氧9mol


 .
. M、N、O、P、Q是元素周期表中原子序数依次递增的前四周期元素.M原子最外层电子数为内层电子数的3倍;N的焰色反应呈黄色;O的氢化物是一种强酸,其浓溶液可与M、Q的化合物反应生成O的单质;P是一种金属元素,其基态原子中有6个未成对电子.请回答下列问题:
M、N、O、P、Q是元素周期表中原子序数依次递增的前四周期元素.M原子最外层电子数为内层电子数的3倍;N的焰色反应呈黄色;O的氢化物是一种强酸,其浓溶液可与M、Q的化合物反应生成O的单质;P是一种金属元素,其基态原子中有6个未成对电子.请回答下列问题: