题目内容
4.下列溶液中微粒的物质的量浓度关系正确的是( )| A. | 常温下0.1 mol•L-1的下列溶液中:①NH4Al(SO4)2、②NH4Cl、③CH3COONH4,c(NH4+) 由大到小的顺序为②>①>③ | |
| B. | 常温下0.4 mol•L-1CH3COOH溶液和0.2 mol•L-1 NaOH溶液等体积混合后溶液显酸性,则溶液中粒子浓度由大到小的顺序为c(CH3COO-)>c(Na+)>c(CH3COOH)>c(H+)>c(OH-) | |
| C. | 0.1 mol•L-1 Na2CO3溶液与0.2 mol•L-1 NaHCO3溶液等体积混合所得溶液中:c(CO32-)+2c(OH-)=c(HCO3-)+3c(H2CO3)+2c(H+) | |
| D. | 0.1 mol•L-1的氨水与0.05 mol•L-1 H2C2O4溶液等体积混合所得溶液中:c(NH4+)+c(NH3•H2O)=2c(C2O42-)+2c(HC2O4-)+2c(H2C2O4) |
分析 A.NH4Al(SO4)2溶液中铵根离子与铝离子水解相互抑制,CH3COONH4中铵根离子与醋酸根离子水解相互促进;
B.反应后溶质为等浓度的醋酸和醋酸钠,混合液呈酸性,说明醋酸的电离程度大于醋酸根离子的水解程度,则c(CH3COO-)>c(CH3COOH),结合物料守恒可知c(CH3COO-)>c(Na+)>c(CH3COOH);
C.根据混合液中的物料守恒和电荷守恒判断;
D.二者反应恰好生成草酸铵,根据草酸铵溶液中的物料守恒分析.
解答 解:A.NH4Al(SO4)2溶液中铵根离子与铝离子水解相互抑制,CH3COONH4中铵根离子与醋酸根离子水解相互促进,所以,相同物质的量浓度的下列溶液中:①NH4Al(SO4)2、②NH4Cl、③CH3COONH4,则c(NH4+)由大到小的顺序是:①>②>③,故A错误;
B.常温下0.4 mol•L-1CH3COOH溶液和0.2 mol•L-1 NaOH溶液等体积混合后溶质为等浓度的醋酸和醋酸钠,混合液呈酸性,说明醋酸的电离程度大于醋酸根离子的水解程度,则c(CH3COO-)>c(CH3COOH),结合物料守恒可知c(CH3COO-)>c(Na+)>c(CH3COOH),则溶液中粒子浓度由大到小的顺序为:c(CH3COO-)>c(Na+)>c(CH3COOH)>c(H+)>c(OH-),故B正确;
C.0.1 mol•L-1 Na2CO3溶液与0.2 mol•L-1 NaHCO3溶液等体积混合所得溶液中,根据电荷守恒可得:①2c(CO32-)+c(OH-)+c(HCO3-)=c(H+)+c(Na+),根据物料守恒可得:②3c(Na+)=4c(CO32-)+4c(H2CO3)+4c(HCO3-),根据①②可得:2c(CO32-)+3c(OH-)=c(HCO3-)+4c(H2CO3)+3c(H+),故C错误;
D.0.1mol•L-1的氨水与0.05 mol•L-1 H2C2O4溶液等体积混合,恰好反应生成草酸铵,根据物料守恒可得:c(NH4+)+c(NH3•H2O)=2c(C2O42-)+2c(HC2O4-)+2c(H2C2O4),故D正确;
故选BD.
点评 本题考查了离子浓度大小比较,题目难度中等,明确发生反应后溶质组成为解答关键,注意掌握电荷守恒、物料守恒及盐的水解原理的含义及应用方法,试题培养了学生的分析能力及灵活应用能力.

| 化合物 | 相对分子质量 | 密度/g•cm-3 | 沸点/℃ | 溶解度/(g/100g水) |
| 正丁醇 | 74 | 0.80 | 118.0 | 9 |
| 冰醋酸 | 60 | 1.045 | 118.1 | 互溶 |
| 乙酸正丁酯 | 116 | 0.882 | 126.1 | 0.7 |
(2)醇可发生分子内脱水生成烯烃,如C2H5OH$?_{170℃}^{浓硫酸}$CH2═CH2↑+H2O
请回答有关问题
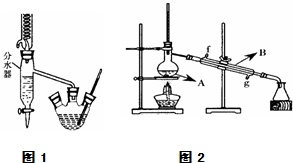
Ⅰ.乙酸正丁酯粗产品的制备
在三孔圆底烧瓶中装入沸石,加入18.5mL正丁醇和15.4mL冰醋酸(稍过量),再加3~4滴浓硫酸.然后安装分水器(作用:实验过程中不断分离除去反应生成的水)、温度计及回流冷凝管,加热冷凝回流反应.
(1)三孔烧瓶和蒸馏烧瓶在加热时都需要加入沸石,加入沸石是作用是防暴沸.本实验过程中可能产生多种有机副产品,请写成其中一种的结构简式CH3CH2CH2CH2OCH2CH2CH2CH3或CH2=CHCH2CH3.
(2)反应时加热有利于提高酯的产率,但实验发现温度过高酯的产率反而降低,可能的原因是乙酸、正丁醇都易挥发,温度过高可能使乙酸、正丁醇大量挥发使产率降低,温度过高可能发生副反应使产率降低.
Ⅱ.乙酸正丁酯粗产品的精制.
(3)将三孔圆底烧瓶中的产物转入分液漏斗中,并用饱和Na2CO3溶液洗涤有机层,接下来进行的操作名称是分液.
(4)将酯层采用如图2所示装置蒸馏.
①图2中仪器B的名称为冷凝管,水的流向应该从g(“f”或“g”)口进入.
②蒸馏收集乙酸正丁酯粗产品时,应将温度控制在126.1℃左右.
| A. | 该合金中铜与镁的物质的量之比是1:2 | |
| B. | 该浓硝酸中HNO3的物质的量浓度是14.0 mol•L-1 | |
| C. | NO2和N2O4的混合气体中,NO2的体积分数是80% | |
| D. | 得到2.54 g沉淀时,加入NaOH溶液的体积是640 mL |

 可逆反应mA(g)+nB(g)?pC(g)+gD(g)的v-t图象如图甲所示,若其他条件都不变,只是在反应前加入合适的催化剂,则其v-t图象如图乙所示.
可逆反应mA(g)+nB(g)?pC(g)+gD(g)的v-t图象如图甲所示,若其他条件都不变,只是在反应前加入合适的催化剂,则其v-t图象如图乙所示.