题目内容
将等物质的量A、B混合于2L的密闭容器中,发生如下反应:3A(g)+B(g)?xC(g)+2D(g),经5min后达到平衡状态,测得D的浓度为0.5mol/L,c(A):c(B)=3:5,C的平均反应速率是0.1mol/(L?min).
(1)x= ;反应开始前放入容器中A、B的物质的量为 mol
(2)5min内,B的平均反应速率为
(3)平衡时,A的转化率为 ,向平衡体系中再加入等物质的量A、B,则A的转化率 (填“增大”“减小”或“不变”)
(1)x=
(2)5min内,B的平均反应速率为
(3)平衡时,A的转化率为
考点:化学平衡的计算
专题:化学平衡专题
分析:(1)根据v=
计算出D的反应速率,然后根据反应速率与化学计量数成正比计算出x;利用化学平衡三段式列式计算出A、B的物质的量;
(2)根据反应速率与化学计量数成正比计算出5min内,B的平均反应速率;
(3)根据D的物质的量计算出达到平衡时消耗A的物质的量,再计算出平衡时A的转化率;该反应是气体体积不变的反应,压强不影响化学平衡,再加入等物质的量的A、B,新平衡与原平衡互为等效平衡,A的转化率不变.
| △c |
| △t |
(2)根据反应速率与化学计量数成正比计算出5min内,B的平均反应速率;
(3)根据D的物质的量计算出达到平衡时消耗A的物质的量,再计算出平衡时A的转化率;该反应是气体体积不变的反应,压强不影响化学平衡,再加入等物质的量的A、B,新平衡与原平衡互为等效平衡,A的转化率不变.
解答:
解:(1)v(D)=
=0.1mol?L-1?min-1,v(C):v(D)=0.1mol?L-1?min-1:0.1mol?L-1?min-1=1:1=x:2,解得:x=2;
设开始前容器中A、B的物质的量都为n,n(D)=0.5mol?L-1×2L=1mol,
3A(g)+B(g)?2C(g)+2D(g),
开始 n n 0 0
转化 1.5mol 0.5mol 1mol 1mol
平衡时 n-1.5 n-0.5 1 1
则:(n-1.5):(n-0.5)=3:5,解得:n=3,
答案为:2;3;
(2)反应速率与化学计量数成正比,则:v(C):v(B)=2:1=0.1mol?L-1?min-1:v(B),
解得:v(B)=0.05mol/(L?min),
故答案为:0.05mol/(L?min);
(3)根据(1)可知,平衡时消耗A的物质的量为1.5mol,则A的转化率为:
×100%=50%;
由于反应恰好气体的体积不变,则压强不影响平衡,所以向平衡体系中再加入等物质的量A、B,达到平衡时,两个平衡互为等效平衡,各组分百分含量不变,A的转化率不变,
故答案为:50%;不变.
| 0.5mol/L |
| 5min |
设开始前容器中A、B的物质的量都为n,n(D)=0.5mol?L-1×2L=1mol,
3A(g)+B(g)?2C(g)+2D(g),
开始 n n 0 0
转化 1.5mol 0.5mol 1mol 1mol
平衡时 n-1.5 n-0.5 1 1
则:(n-1.5):(n-0.5)=3:5,解得:n=3,
答案为:2;3;
(2)反应速率与化学计量数成正比,则:v(C):v(B)=2:1=0.1mol?L-1?min-1:v(B),
解得:v(B)=0.05mol/(L?min),
故答案为:0.05mol/(L?min);
(3)根据(1)可知,平衡时消耗A的物质的量为1.5mol,则A的转化率为:
| 1.5mol |
| 3mol |
由于反应恰好气体的体积不变,则压强不影响平衡,所以向平衡体系中再加入等物质的量A、B,达到平衡时,两个平衡互为等效平衡,各组分百分含量不变,A的转化率不变,
故答案为:50%;不变.
点评:本题考查了化学平衡的计算,题目难度中等,注意掌握等效平衡的判断、化学反应速率、转化率的概念及计算方法,明确化学反应速率与化学计量数成正比为解答关键.

练习册系列答案
相关题目
设NA为阿伏加德罗常数的数值,下列说法中,正确的是( )
| A、标准状况下,22.4L Cl2完全反应时,转移电子数一定为2NA |
| B、常温下,l LpH=l的H2SO4溶液中含有的H+的数目为0.2NA |
| C、标准状况下,2.24 L NH3中含有共价键的数目为NA |
| D、常温下,23 g NO2和N2O4的混合气体中含有NA个氧原子 |
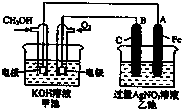
如图所示,其中甲池的总反应式为:2CH3OH+3O2+4KOH═2K2CO3+6H2O下列说法正确的是( )
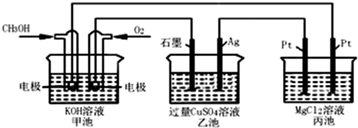

| A、甲池是电能转化为化学能的装置,乙、丙池是化学能转化电能的装置 |
| B、甲池通入CH3OH的电极反应为CH3OH-6e?+2H2O═CO32?+8H+ |
| C、反应一段时间后,向乙池中加入一定量Cu(OH)2固体,能使CuSO4溶液恢复到原浓度 |
| D、甲池中消耗224 mL(标准状况下)O2,此时乙池中银电极上产生1.28g固体 |
一定条件下,在体积为2L的密闭容器中,3molX和3mol Y发生反应:3X(g)+Y(g)?2Z(g),经60s达到平衡,生成0.4mol Z.下列说法正确的是( )
| A、60s内反应速率为v(X)=0.05 mol/(L?s),X的转化率为80% | ||
| B、其它条件不变,若初始投入2mol X和2mol Y则物质Y的转化率减小 | ||
| C、其它条件不变,若升高温度,X的体积分数增大,则该反应的△H>0 | ||
D、其它条件不变,将容器体积变为4L,Z的平衡浓度变为原来的
|
将一定量的钠铝合金置于水中,合金全部溶解,往溶液中加入1mol/L盐酸20mL,此时沉淀量达到最大值,则原合金中钠的质量为( )
| A、0.46g |
| B、0.02g |
| C、0.80g |
| D、0.23g |
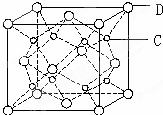 有A、B、C、D、E五种原子序数依次增大的元素(原子序数均小于30).A的基态原子2p能级有3个单电子;C的基态原子2p能级有1个单电子;E的原子序数为29;D与E同周期,价电子数为2.则:
有A、B、C、D、E五种原子序数依次增大的元素(原子序数均小于30).A的基态原子2p能级有3个单电子;C的基态原子2p能级有1个单电子;E的原子序数为29;D与E同周期,价电子数为2.则: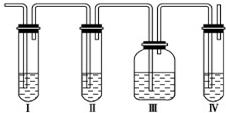 实验室制取乙烯:C2H5OH
实验室制取乙烯:C2H5OH 
 目前工业上利用CO2来生产燃料甲醇,可将CO2变废为宝.
目前工业上利用CO2来生产燃料甲醇,可将CO2变废为宝.