题目内容
6.回答下列问题:(1)已知下列反应:SO2(g)+2OH- (aq)═SO32- (aq)+H2O(l)△H1
ClO- (aq)+SO32- (aq)═SO42- (aq)+Cl- (aq)△H2CaSO4(s)═Ca2+(aq)+SO42-(aq)△H3
则反应SO2(g)+Ca2+(aq)+ClO- (aq)+2OH- (aq)═CaSO4(s)+H2O(l)+Cl- (aq)的△H=△H1+△H2-△H3.(用△H1△H2△H3表示)
(2)工业上用H2和Cl2反应制HCl,各键能数据为:H-H:436kJ/mol,Cl-Cl:243kJ/mol,H-Cl:431kJ/mol.该反应的热化学方程式是H2(g)+Cl2(g)=2HCl(g)△H=-183 kJ/mol.
(3)合成气(CO和H2为主的混合气体)不但是重要的燃料也是重要的化工原料,制备合成气的方法有多种,用甲烷制备合成气的反应为:
①2CH4(g)+O2(g)═2CO(g)+4H2(g);△H1=-72kJ•mol-1
②CH4(g)+H2O(g)═CO(g)+3H2(g);△H2=+216kJ•mol-1
氢气与氧气反应生成水蒸气的热化学方程式为H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H=-252kJ•mol-1.
现有1mol由H2O(g)与O2组成的混合气,且O2的体积分数为x,将此混合气与足量CH4充分反应.若x=0.2时,反应①放出的能量为14.4kJ;若x=0.75时,反应①与②放出(或吸收)的总能量为0.
(4)一定条件,在水溶液中1 mol Cl-和1mol ClOx-(x=1,2,3,4)的能量(KJ)相对大小如图所示.
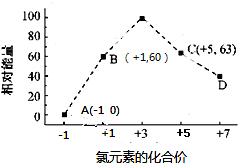
①D是ClO4-(填离子符号).
②B→A+C反应的热化学方程式为3ClO-(aq)=ClO3-(aq)+2Cl-(aq)△H=-117kJ/mol(用离子符号表示).
分析 (1)已知SO2(g)+2OH-(aq)═SO32-(aq)+H2O(l)△H1
ClO-(aq)+SO32-(aq)═SO42-(aq)+Cl-(aq)△H2
CaSO4(s)═Ca2+(aq)+SO42-(aq)△H3
则根据盖斯定律可知①+②-③即得到所需热化学方程式;
(2)反应方程式为:H2+Cl2=2HCl,根据吸收的能量之和与放出的能量之和的相对大小判断反应的吸放热,二者的差值即为焓变的数值;
(3)据热化学方程式和盖斯定律计算写出热化学方程式;据图象写出水与甲烷反应的热化学方程式和氧气与甲烷反应的热化学方程式,再据热化学方程式计算;
(4)一定条件下,在水溶液1 mol Cl-、ClOx-(x=1,2,3,4,)的能量(kJ)相对大小如图所示.
①D中Cl元素化合价为+7价,据此判断x值;
②B→A+C,根据转移电子守恒得该反应方程式为3ClO-=ClO3-+2Cl-,反应热=(63kJ/mol+2×0kJ/mol)-3×60kJ/mol=-117kJ/mol;
解答 解:(1)已知SO2(g)+2OH-(aq)═SO32-(aq)+H2O(l)△H1
ClO-(aq)+SO32-(aq)═SO42-(aq)+Cl-(aq)△H2
CaSO4(s)═Ca2+(aq)+SO42-(aq)△H3
则根据盖斯定律可知①+②-③即得到反应SO2(g)+Ca2+(aq)+ClO-(aq)+2OH-(aq)═CaSO4(s)+H2O(l)+Cl-(aq)△H=△H1+△H2-△H3.
故答案为:△H1+△H2-△H3;
(2)反应方程式为:H2+Cl2=2HCl,生成2molHCl,需吸收能量:436kJ+243kJ=679kJ,放出能量:2×431kJ=862kJ,放出的能量大于吸收的能量,则该反应放热,焓变为负号,且放出的热量为:864kJ-679kJ=185kJ,所以△H=-183KJ/mol,所以反应的热化学方程式是H2(g)+Cl2(g)=2HCl(g)△H=-183 kJ/mol;
故答案为:H2(g)+Cl2(g)=2HCl(g)△H=-183 kJ/mol;
(3)①2CH4(g)+O2(g)═2CO(g)+4H2(g);△H1=-72kJ•mol-1
②CH4(g)+H2O(g)═CO(g)+3H2(g)△H2=+216 kJ•mol-1
依据盖斯定律 $\frac{1}{2}$①-②得到氢气与氧气反应生成水蒸气的热化学方程式为:
H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H=-252kJ•mol-1,
CH4(g)+H2O(g)═CO(g)+3H2(g);△H2=+216kJ•mol-1
2CH4(g)+O2(g)═2CO(g)+4H2(g);△H1=-72kJ•mol-1,
若x=0.2,有0.8molH2O(g)和0.2molO2(g),0.2mol氧气反应放热0.2mol×36KJ/mol×2=14.4KJ;
反应①与②放出(或吸收)的总能量为0时,设水蒸气物质的量为amol,则氧气物质的量为(1-a)mol,有216KJ/mol×amol=72KJ/mol×(1-a)mol,解得:a=0.26mol,所以x=$\frac{1-0.26}{1}$=0.75;
故答案为:H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H=-252kJ•mol-1;14.4;0.75;
(4)①根据图象知,D中Cl元素化合价为+7价,所以ClOx-中x为4,则D为ClO4-,故答案为:ClO4-;
②B→A+C,根据转移电子守恒得该反应方程式为3ClO-=ClO3-+2Cl-,反应热=(63kJ/mol+2×0kJ/mol)-3×60kJ/mol=-117kJ/mol,所以该热化学反应方程式为:3ClO-(aq)=ClO3-(aq)+2Cl-(aq)△H=-117kJ/mol,
故答案为:3ClO-(aq)=ClO3-(aq)+2Cl-(aq)△H=-117kJ/mol;
点评 本题考查了热化学方程式书写和热化学方程式的计算、能量变化图象分析、盖斯定律的计算应用,注意键能和焓变的计算应用,题目难度中等.

| A. | 相同质量的CO2(g)和干冰相比较,干冰的能量一定高于CO2(g) | |
| B. | 化学反应过程中能量的变化只可能有吸热和放热两种表现形式 | |
| C. | 同温同压下,反应H2(g)+Cl2(g)═2HCl(g)在光照和点燃条件的△H相同 | |
| D. | 放热的反应在常温下一定能自发进行 |
| A. | 磺化、硝化、水化、风化、钝化等都是化学变化 | |
| B. | 干馏、常压分馏、减压分馏都是物理变化 | |
| C. | 甘油不是油,纯碱不是碱,酚醛树脂不是酯,干冰不是冰 | |
| D. | 水煤气、裂解气、焦炉气、天然气都是混合物 |
| A. | 用热的Na2CO3溶液去除油污:CO32-+H2O═HCO3-+OH- | |
| B. | 用FeS去除废水中的Hg2+:Hg2++S2-═HgS↓ | |
| C. | 用催化法处理汽车尾气中的CO和NO:CO+NO$\frac{\underline{\;催化剂\;}}{\;}$C+NO2 | |
| D. | 向污水中投放明矾,生成能凝聚悬浮物的胶体:Al3++3H2O?Al(OH)3(胶体)+3H+ |
| A. | O、S、Na的原子半径依次增大 | B. | LiOH、NaOH、KOH的碱性依次减弱 | ||
| C. | NH3、H2O(气态)、HF的稳定性依次减弱 | D. | Cl2、Br2、I2的氧化性依次增强 |
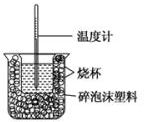 已知在稀溶液中,酸跟碱发生中和反应生成1mol水时的反应热叫做中和热.现利用如图装置进行中和热的测定,请回答下列问题:
已知在稀溶液中,酸跟碱发生中和反应生成1mol水时的反应热叫做中和热.现利用如图装置进行中和热的测定,请回答下列问题: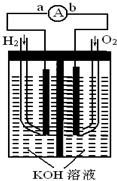 燃料电池是一种能量转换效率高、对环境友好的化学电源,图为一种氢氧燃料电池的结构装置.
燃料电池是一种能量转换效率高、对环境友好的化学电源,图为一种氢氧燃料电池的结构装置.