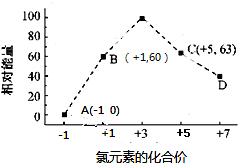
题目内容
14.下列说法正确的是( )| A. | 相同质量的CO2(g)和干冰相比较,干冰的能量一定高于CO2(g) | |
| B. | 化学反应过程中能量的变化只可能有吸热和放热两种表现形式 | |
| C. | 同温同压下,反应H2(g)+Cl2(g)═2HCl(g)在光照和点燃条件的△H相同 | |
| D. | 放热的反应在常温下一定能自发进行 |
分析 A.气态二氧化碳具有的能量大于固态;
B.化学反应中的能量出热量外,还可以表现为光能、电能;
C.根据盖斯定律可知,化学反应中的能量变化与反应途径无关,与反应物、生成物状态有关;
D.有的放热反应需要加热或点燃.
解答 解:A.干冰为固态二氧化碳,相同质量的CO2(g)和干冰相比较具有相同物质的量,干冰的能量一定低于CO2(g),故A错误;
B.化学反应中的能量变化除了热量外还可以是光能、电能等,如燃烧发光、放热,原电池还可以转换成电能,故B错误;
C.反应的焓变与反应物和生成物的能量有关,与反应条件、变化过程无关,故C正确;
D.放热反应在常温下不一定能够自发进行,如氢气与氧气的反应需要点燃,故D错误;
故选C.
点评 本题考查了反应热与焓变的关系,题目难度不大,明确常见化学反应与能量变化的关系为解答关键,D为易错点,注意吸热反应、放热反应与反应条件之间的关系,试题侧重基础知识的考查,有利于提高学生的分析能力及灵活应用能力.

练习册系列答案
相关题目
10.某聚酯纤维结构如下: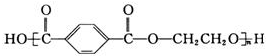 ,下列说法正确的是( )
,下列说法正确的是( )
 ,下列说法正确的是( )
,下列说法正确的是( )| A. | 由单体合成该聚酯纤维的反应属于加聚反应 | |
| B. | 该聚酯纤维不能水解 | |
| C. | 该聚酯纤维单体为对苯二甲酸和乙二醇 | |
| D. | 该聚酯纤维含有亲水基羟基,在水中溶解度较大 |
2.在下列各说法中,正确的是( )
| A. | 1 mol H2与0.5 molO2反应放出的热就是H2的燃烧热 | |
| B. | 1 mol H2SO4与1 molBa(OH)2反应时放出的热叫做中和热 | |
| C. | 热化学方程式中的化学计量数表示物质的量,可以是分数 | |
| D. | △H>0表示放热反应,△H<0 表示吸热反应 |
19.有机物X能实现下列转化,有机物Z中含有羧基,有机物Y中含有一个羧基,下列判断错误的是( )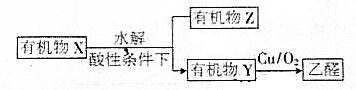

| A. | X可能是淀粉或纤维素 | B. | Y与CH3OCH3互为同分异构体 | ||
| C. | Z可能含有多个羧基 | D. | X中含有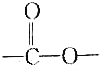 |
3.下列对有机物结构或性质的描述,正确的是( )


| A. | 0.1mol羟基中含有1 mol电子 | |
| B. | 乙烷和丙烯任意比混合的气体1mol,完成燃烧均生成3molH2O | |
| C. | CH2Cl2具有两种同分异构体 | |
| D. | 图中有机物(1-甲基环己烷)的一氯代物有4种 |
4.欧盟原定于2012年1月1日起征收航空碳排税以应对冰川融化和全球变暖,使得对如何降低大气中CO2的含量及有效地开发利用碳资源的研究显得更加紧迫.请运用化学反应原理的相关知识研究碳及其化合物的性质.
(1)用电弧法合成的储氢纳米碳管常伴有大量的碳纳米颗粒(杂质),这种颗粒可用如下氧化法提纯,请完成该反应的化学方程式:
5 C+4 KMnO4+6 H2SO4→5CO2↑+4MnSO4+2K2SO4+6H2O
(2)焦炭可用于制取水煤气.测得12g碳与水蒸气完全反应生成水煤气时,吸收了131.6kJ热量.该反应的热化学方程式为C(s)+H2O(g)=CO(g)+H2(g)△H=+131.6kJ•mol-1.
(3)工业上在恒容密闭容器中用下列反应合成甲醇:
CO(g)+2H2(g)$?_{加热}^{催化剂}$CH3OH(g)△H=akJ/mol.
如表所列数据是反应在不同温度下的化学平衡常数(K).
①判断反应达到平衡状态的依据是BD.
A.生成CH3OH的速率与消耗CO的速率相等
B.混合气体的平均相对分子质量不变
C.混合气体的密度不变
D.CH3OH、CO、H2的浓度都不再发生变化
②某温度下,将2mol CO和一定量的H2充入2L的密闭容器中,充分反应10min后,达到平衡时测得c(CO)=0.2mol/L,则以H2表示的反应速率v(H2)=0.16mol/(L•min).
(4)CO还可以用做燃料电池的燃料,某熔融盐燃料电池具有高的发电效率,因而受到重视,该电池用Li2CO3和Na2CO3的熔融盐混合物作电解质,CO为负极燃气,空气与CO2的混合气为正极助燃气,制得在650℃下工作的燃料电池,其正极反应式:O2+2CO2+4e-═2CO32-,则负极反应式:2CO-4e-+2CO32-=4CO2.
(5)向BaSO4沉淀中加入饱和碳酸钠溶液,充分搅拌,弃去上层清液,如此处理多次,可使BaSO4全部转化为BaCO3,发生反应:BaSO4(s)+CO32-(aq)═BaCO3(s)+SO42-(aq).已知某温度下该反应的平衡常数K=4.0×10-2,BaSO4的Ksp=1.0×10-10,则 BaCO3的溶度积Ksp=2.5×10-9.
(1)用电弧法合成的储氢纳米碳管常伴有大量的碳纳米颗粒(杂质),这种颗粒可用如下氧化法提纯,请完成该反应的化学方程式:
5 C+4 KMnO4+6 H2SO4→5CO2↑+4MnSO4+2K2SO4+6H2O
(2)焦炭可用于制取水煤气.测得12g碳与水蒸气完全反应生成水煤气时,吸收了131.6kJ热量.该反应的热化学方程式为C(s)+H2O(g)=CO(g)+H2(g)△H=+131.6kJ•mol-1.
(3)工业上在恒容密闭容器中用下列反应合成甲醇:
CO(g)+2H2(g)$?_{加热}^{催化剂}$CH3OH(g)△H=akJ/mol.
如表所列数据是反应在不同温度下的化学平衡常数(K).
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
A.生成CH3OH的速率与消耗CO的速率相等
B.混合气体的平均相对分子质量不变
C.混合气体的密度不变
D.CH3OH、CO、H2的浓度都不再发生变化
②某温度下,将2mol CO和一定量的H2充入2L的密闭容器中,充分反应10min后,达到平衡时测得c(CO)=0.2mol/L,则以H2表示的反应速率v(H2)=0.16mol/(L•min).
(4)CO还可以用做燃料电池的燃料,某熔融盐燃料电池具有高的发电效率,因而受到重视,该电池用Li2CO3和Na2CO3的熔融盐混合物作电解质,CO为负极燃气,空气与CO2的混合气为正极助燃气,制得在650℃下工作的燃料电池,其正极反应式:O2+2CO2+4e-═2CO32-,则负极反应式:2CO-4e-+2CO32-=4CO2.
(5)向BaSO4沉淀中加入饱和碳酸钠溶液,充分搅拌,弃去上层清液,如此处理多次,可使BaSO4全部转化为BaCO3,发生反应:BaSO4(s)+CO32-(aq)═BaCO3(s)+SO42-(aq).已知某温度下该反应的平衡常数K=4.0×10-2,BaSO4的Ksp=1.0×10-10,则 BaCO3的溶度积Ksp=2.5×10-9.