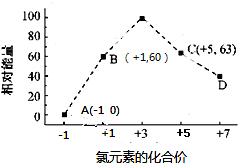
题目内容
17.电能是现代社会应用最广泛的能源之一.如图所示的原电池装置中,其负极是Zn,正极上观察到的现象是铜片表面产生无色气泡,正极的电极反应式是2H++2e-=H2↑.若把电解质溶液换成硫酸铜溶液,则正极的电极反应式为Cu2++2e-=Cu,该电池工作一段时间后,若消耗锌6.5g,则电路中转移的电子数为0.2NA(NA代表阿伏加德罗常数).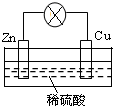
分析 锌比铜活泼,在稀硫酸中形成原电池反应,锌做负极,氢离子在正极Cu上得电子生成氢气,
若把电解质溶液换成硫酸铜溶液,正极上是铜离子得到电子生成铜,根据消耗的金属的质量计算物质的量,结合电极反应计算电子转移总数.
解答 解:由于锌比铜活泼,所以锌做负极,所以消耗的金属为锌.
锌失电子生成锌离子进入溶液,电极反应式为锌片:Zn-2e-=Zn2+,铜片上氢离子得电子生成氢气,所以电极反应式为2H++2e-=H2↑,
总反应:Zn+2H+=H2↑+Zn2+
若把电解质溶液换成硫酸铜溶液,正极上是铜离子得到电子生成铜,则正极的电极反应式为:Cu2++2e-=Cu,
该电池工作一段时间后,若消耗锌6.5g,n=$\frac{6.5g}{65g/mol}$=0.1mol,Zn-2e-=Zn2+,则电路中转移的电子数=0.1mol×2×NA=0.2NA,
故答案为:Zn;铜片表面产生无色气泡; 2H++2e-=H2↑; Cu2++2e-=Cu;0.2NA.
点评 本题考查了原电池原理、电极反应书写、电子守恒的计算等知识点,掌握原电池原理是解题关键,题目难度不大.

练习册系列答案
 应用题天天练四川大学出版社系列答案
应用题天天练四川大学出版社系列答案
相关题目
13.电解冶炼铝时使用了助熔剂Na3AlF6,在电解槽中存在电解质W2[X2Y2Z4],Y原子最外层电子数为次外层的3倍,X原子最外层电子数为Y原子最外层电子数的一半.下列说法正确的是( )
| A. | 原子序数:W>X>Y>Z | B. | 原子半径:W>X>Y>Z | ||
| C. | W的最高价氢氧化物的碱性比X弱 | D. | Y的最简单氢化物的稳定性比Z的强 |
12.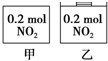 甲、乙两个容器中最初存在的物质及数量如图所示,两个容器最初的容积相等、温度相同,反应中甲的容积不变,乙中的压强不变,在一定温度下反应达到平衡.下列说法正确的是( )
甲、乙两个容器中最初存在的物质及数量如图所示,两个容器最初的容积相等、温度相同,反应中甲的容积不变,乙中的压强不变,在一定温度下反应达到平衡.下列说法正确的是( )
 甲、乙两个容器中最初存在的物质及数量如图所示,两个容器最初的容积相等、温度相同,反应中甲的容积不变,乙中的压强不变,在一定温度下反应达到平衡.下列说法正确的是( )
甲、乙两个容器中最初存在的物质及数量如图所示,两个容器最初的容积相等、温度相同,反应中甲的容积不变,乙中的压强不变,在一定温度下反应达到平衡.下列说法正确的是( )| A. | 平衡时各容器内c(NO2)的大小顺序为乙>甲 | |
| B. | 平衡时N2O4的百分含量:乙>甲 | |
| C. | 平衡时甲中的压强与乙中的压强:甲>乙 | |
| D. | 平衡时混合物的平均相对分子质量:甲>乙 |
2.在下列各说法中,正确的是( )
| A. | 1 mol H2与0.5 molO2反应放出的热就是H2的燃烧热 | |
| B. | 1 mol H2SO4与1 molBa(OH)2反应时放出的热叫做中和热 | |
| C. | 热化学方程式中的化学计量数表示物质的量,可以是分数 | |
| D. | △H>0表示放热反应,△H<0 表示吸热反应 |
7.铝与过量的稀盐酸反应,为了加快反应速率,但是又不影响生成的氢气总量,可以采取的措施是( )
| A. | 降低温度 | B. | 加入适量的水 | ||
| C. | 加入少量CuSO4溶液 | D. | 加入浓度较大的盐酸 |
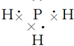 ,结构式
,结构式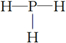 .
.