题目内容
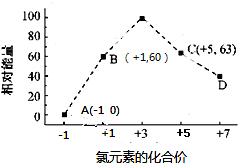
11.下列与处理方法对应的反应方程式正确的是( )| A. | 用热的Na2CO3溶液去除油污:CO32-+H2O═HCO3-+OH- | |
| B. | 用FeS去除废水中的Hg2+:Hg2++S2-═HgS↓ | |
| C. | 用催化法处理汽车尾气中的CO和NO:CO+NO$\frac{\underline{\;催化剂\;}}{\;}$C+NO2 | |
| D. | 向污水中投放明矾,生成能凝聚悬浮物的胶体:Al3++3H2O?Al(OH)3(胶体)+3H+ |
分析 A.水解为可逆反应,且以第一步水解为主;
B.FeS在离子反应中保留化学式;
C.反应生成氮气和二氧化碳;
D.明矾水解生成胶体,可净化水.
解答 解:A.用热的Na2CO3溶液去除油污的水解离子反应为CO32-+H2O?HCO3-+OH-,故A错误;
B.用FeS去除废水中的Hg2+的离子反应为Hg2++FeS═HgS↓+Fe2+,故B错误;
C.用催化法处理汽车尾气中的CO和NO的离子反应为2CO+2NO$\frac{\underline{\;催化剂\;}}{\;}$N2+2CO2,故C错误;
D.向污水中投放明矾,生成能凝聚悬浮物的胶体的水解反应为Al3++3H2O?Al(OH)3(胶体)+3H+,故D正确;
故选D.
点评 本题考查离子反应方程式的书写,为高频考点,把握发生的反应、离子反应的书写方法为解答的关键,侧重分析与应用能力的考查,注意水解反应的书写方法,题目难度不大.

练习册系列答案
 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案
相关题目
1.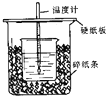 (1)在如图所示的装置中,50mL0.50mol•L-1盐酸与50mL0.55mol•L-1NaOH溶液进行中和反应,通过测定该反应过程中所放出的热量可计算中和热.回答下列问题:
(1)在如图所示的装置中,50mL0.50mol•L-1盐酸与50mL0.55mol•L-1NaOH溶液进行中和反应,通过测定该反应过程中所放出的热量可计算中和热.回答下列问题:
①从实验装置上看,图中尚缺少的一种玻璃用品是环形玻璃搅拌棒.
②若用相同浓度和体积的氨水代替NaOH溶液进行上述实验,所测得的中和热的数值会偏小(填“偏大”“偏小”“无影响”).
(2)某探究实验小组的同学,在进行高锰酸钾酸性溶液与草酸溶液的反应时,发现刚开始的一段时间,反应速率较慢,溶液褪色不明显,但不久后褪色速度明显加快,最后紫红色完全消失.已知草酸与高锰酸钾酸性溶液的反应为:
2KMnO4+5H2C2O4+3H2SO4═K2SO4+2MnSO4+10CO2+8H2O
该小组探究后一阶段褪色速度明显加快的原因:
①设计对比实验:室温下,在三支试管中各加入4mL0.01mol•L-1KMnO4酸性溶液和2mL0.1mol•L-1H2C2O4溶液,再对应加入固体粉末,记录褪色时间.实验数据如下:
设计该实验的目的及实验得出的结论分别是:探究后一阶段褪色速度明显加快的原因;Mn2+作催化剂,加快反应速率;.
②理论分析:依据该反应的原理,推测反应可能是放热反应,温度影响了反应的速率.请你设计一个简单的实验来验证该推测.你的实验操作是:取一支试管,向其中各加入4mL0.01mol•L-1KMnO4酸性溶液和2mL0.1mol•L-1H2C2O4溶液,然后放入冰水混合物中,观察褪色时间.
(3)某研究发现O3氧化海水中的I-是大气中碘的主要来源.通过将O3通入稀硫酸酸化的NaI溶液中进行模拟研究,为测定生成I2的量,用酸式滴定管取20.00mL反应后的溶液与锥形瓶中,用cmol•L-1的Na2S2O3标准液滴定,消耗V mL Na2S2O3溶液.
已知:Ⅰ.H2S2O3是一种弱酸;Ⅱ.2Na2S2O3+I2═Na2S4O6+2NaI
①该滴定实验中除烧杯、锥形瓶、酸式滴定管外,还需要的玻璃仪器是碱式滴定管;
②该滴定实验中可选用淀粉作指示剂(填物质名称);
③实验测得溶液中碘的含量为6.35cVg•L-1(用含c和V的关系式表示).
 (1)在如图所示的装置中,50mL0.50mol•L-1盐酸与50mL0.55mol•L-1NaOH溶液进行中和反应,通过测定该反应过程中所放出的热量可计算中和热.回答下列问题:
(1)在如图所示的装置中,50mL0.50mol•L-1盐酸与50mL0.55mol•L-1NaOH溶液进行中和反应,通过测定该反应过程中所放出的热量可计算中和热.回答下列问题:①从实验装置上看,图中尚缺少的一种玻璃用品是环形玻璃搅拌棒.
②若用相同浓度和体积的氨水代替NaOH溶液进行上述实验,所测得的中和热的数值会偏小(填“偏大”“偏小”“无影响”).
(2)某探究实验小组的同学,在进行高锰酸钾酸性溶液与草酸溶液的反应时,发现刚开始的一段时间,反应速率较慢,溶液褪色不明显,但不久后褪色速度明显加快,最后紫红色完全消失.已知草酸与高锰酸钾酸性溶液的反应为:
2KMnO4+5H2C2O4+3H2SO4═K2SO4+2MnSO4+10CO2+8H2O
该小组探究后一阶段褪色速度明显加快的原因:
①设计对比实验:室温下,在三支试管中各加入4mL0.01mol•L-1KMnO4酸性溶液和2mL0.1mol•L-1H2C2O4溶液,再对应加入固体粉末,记录褪色时间.实验数据如下:
| 实验序号 | A | B | C |
| 加入试剂 | KMnO4、H2C2O4 | KMnO4、H2C2O4 1gMnSO4粉末 | KMnO4、H2C2O4 1gNa2SO4粉末 |
| 完全褪色时间/s | 116 | 6 | 117 |
②理论分析:依据该反应的原理,推测反应可能是放热反应,温度影响了反应的速率.请你设计一个简单的实验来验证该推测.你的实验操作是:取一支试管,向其中各加入4mL0.01mol•L-1KMnO4酸性溶液和2mL0.1mol•L-1H2C2O4溶液,然后放入冰水混合物中,观察褪色时间.
(3)某研究发现O3氧化海水中的I-是大气中碘的主要来源.通过将O3通入稀硫酸酸化的NaI溶液中进行模拟研究,为测定生成I2的量,用酸式滴定管取20.00mL反应后的溶液与锥形瓶中,用cmol•L-1的Na2S2O3标准液滴定,消耗V mL Na2S2O3溶液.
已知:Ⅰ.H2S2O3是一种弱酸;Ⅱ.2Na2S2O3+I2═Na2S4O6+2NaI
①该滴定实验中除烧杯、锥形瓶、酸式滴定管外,还需要的玻璃仪器是碱式滴定管;
②该滴定实验中可选用淀粉作指示剂(填物质名称);
③实验测得溶液中碘的含量为6.35cVg•L-1(用含c和V的关系式表示).
2.在下列各说法中,正确的是( )
| A. | 1 mol H2与0.5 molO2反应放出的热就是H2的燃烧热 | |
| B. | 1 mol H2SO4与1 molBa(OH)2反应时放出的热叫做中和热 | |
| C. | 热化学方程式中的化学计量数表示物质的量,可以是分数 | |
| D. | △H>0表示放热反应,△H<0 表示吸热反应 |
19.有机物X能实现下列转化,有机物Z中含有羧基,有机物Y中含有一个羧基,下列判断错误的是( )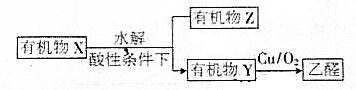

| A. | X可能是淀粉或纤维素 | B. | Y与CH3OCH3互为同分异构体 | ||
| C. | Z可能含有多个羧基 | D. | X中含有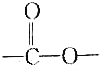 |
16.下列关于有机物的说法正确的是( )
| A. | 淀粉、纤维素、蛋白质都是天然高分子化合物,都能发生水解反应 | |
| B. | 蔗糖和葡萄糖不是同分异构体,但属同系物 | |
| C. | 苯酚、甲醛通过加聚反应可制得酚醛树脂 | |
| D. | 石油裂解和煤的干馏都是化学变化,而石油的分馏和煤的气化都是物理变化 |
3.下列对有机物结构或性质的描述,正确的是( )


| A. | 0.1mol羟基中含有1 mol电子 | |
| B. | 乙烷和丙烯任意比混合的气体1mol,完成燃烧均生成3molH2O | |
| C. | CH2Cl2具有两种同分异构体 | |
| D. | 图中有机物(1-甲基环己烷)的一氯代物有4种 |
20.如图,烧杯中的溶质均足量,a、b、c、d、e均为石墨电极,通电一段时间后,a电极上有红色物质析出,以下说法正确的是( )


| A. | B烧杯中加一定量的KCl固体可使溶液恢复原状 | |
| B. | c电极周围溶液变红 | |
| C. | A烧杯内Cu2+浓度降低 | |
| D. | d电极上可以析出使湿润的淀粉KI试纸变蓝的气体 |