题目内容
在水中加入下列物质,可使水的电离平衡向右移动的是( )
| A、硫酸 | B、氢氧化钾 |
| C、氯化铁 | D、硝酸钡 |
考点:弱电解质在水溶液中的电离平衡,水的电离,盐类水解的原理
专题:
分析:水的电离方程式为H2O?H++OH-,酸或碱抑制水电离,含有弱离子的盐促进水电离,据此分析解答.
解答:
解:水的电离方程式为H2O?H++OH-,
A.硫酸电离出H+而使溶液中H+浓度增大,抑制水电离,则水的电离平衡向左移动,故A错误;
B.KOH电离出OH-而使溶液中OH-浓度增大,抑制水电离,则水的电离平衡向左移动,故B错误;
C.Fe3++3H3O?Fe(OH)3+3H+,铁离子水解促进水电离,则水的电离平衡向右移动,故C正确;
D.硝酸钡是强酸强碱盐,不水解,所以不促进水电离也不抑制水电离,故D错误;
故选C.
A.硫酸电离出H+而使溶液中H+浓度增大,抑制水电离,则水的电离平衡向左移动,故A错误;
B.KOH电离出OH-而使溶液中OH-浓度增大,抑制水电离,则水的电离平衡向左移动,故B错误;
C.Fe3++3H3O?Fe(OH)3+3H+,铁离子水解促进水电离,则水的电离平衡向右移动,故C正确;
D.硝酸钡是强酸强碱盐,不水解,所以不促进水电离也不抑制水电离,故D错误;
故选C.
点评:本题考查影响弱电解质电离平衡的因素,明确加入的物质性质是解本题关键,根据溶液中氢离子或氢氧根离子浓度变化确定对水电离的影响,题目难度不大.

练习册系列答案
相关题目
已知下列热化学方程式:H2(g)+
O2(g)═H2O(l)△H=-285.8kJ/mol,H2(g)+
O2(g)═H2O(g)△H=-241.8kJ/mol则氢气的标准燃烧热是( )
| 1 |
| 2 |
| 1 |
| 2 |
| A、-285.8kJ/mol |
| B、285.8kJ/mol |
| C、-241.8kJ/mol |
| D、241.8kJ/mol |
下列反应能用化合直接制得的是( )
①FeCl2②FeCl3③Fe(OH)3④Fe(OH)2⑤Cu2S.
①FeCl2②FeCl3③Fe(OH)3④Fe(OH)2⑤Cu2S.
| A、①②③⑤ | B、②⑤ |
| C、②③⑤ | D、全部 |
将0.2mol?L-1HCN溶液和0.1mol?L-1的NaOH溶液等体积混合后,溶液显碱性,下列关系式中正确的是( )
| A、c (HCN)<c (CN-) |
| B、c (Na+)>c (CN-) |
| C、c (HCN)-c (CN-)=c (OH-) |
| D、c (HCN)+c (CN-)=0.1mol?L-1 |
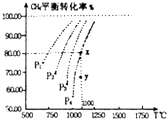 在一恒容的密闭窗口中充入0.1mol/LCO2,0.1mol/L CH4,在一定条件下发生反应:CH4(g)+CO2(g)?2CO(g)+2H2(g),测得CH4平衡时转化率与温度、压强关系如图,下列有关说法不正确的是( )
在一恒容的密闭窗口中充入0.1mol/LCO2,0.1mol/L CH4,在一定条件下发生反应:CH4(g)+CO2(g)?2CO(g)+2H2(g),测得CH4平衡时转化率与温度、压强关系如图,下列有关说法不正确的是( )| A、上述反应的△H<0 |
| B、压强:P4>P3>P2>P1 |
| C、1100℃时该反应平衡常数为1.64 |
| D、压强为P4时,在y点:V正>V逆 |
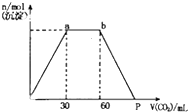 向Ba(OH)2和KOH混合液中缓缓通入CO2气体至过量,生成沉淀物质的量与通入CO2气体体积VmL的关系如图所示,下列结论中正确的是( )
向Ba(OH)2和KOH混合液中缓缓通入CO2气体至过量,生成沉淀物质的量与通入CO2气体体积VmL的关系如图所示,下列结论中正确的是( )| A、原混合物中n[Ba(OH)2]:n(KOH)=1:2 |
| B、p点坐标为120mL |
| C、p点溶液中溶质为Ba(HCO3)2 |
| D、a,b段反应分二阶段,离子方程式为:CO2+2OH-=CO32-+H2O CO32-+H2O+CO2=2HCO3- |
下列各说法中,正确的是( )
| A、△H>0表示放热反应,△H<0表示吸热反应 |
| B、热化学方程式中的化学计量数只表示物质的量,可以是分数 |
| C、1mol H2SO4与1mol Ba(OH)2反应生成BaSO4沉淀时放出的热叫做中和热 |
| D、1mol H2与0.5molO2反应放出的热就是H2的燃烧热 |
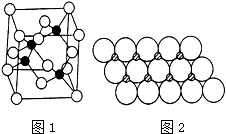 Ⅰ.砷化镓为第三代半导体,以其为材料制造的灯泡寿命长、耗能少.已知砷化镓的晶胞结构如图1所示.请回答下列问题:
Ⅰ.砷化镓为第三代半导体,以其为材料制造的灯泡寿命长、耗能少.已知砷化镓的晶胞结构如图1所示.请回答下列问题: