题目内容
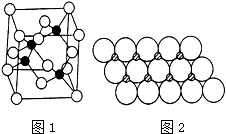 Ⅰ.砷化镓为第三代半导体,以其为材料制造的灯泡寿命长、耗能少.已知砷化镓的晶胞结构如图1所示.请回答下列问题:
Ⅰ.砷化镓为第三代半导体,以其为材料制造的灯泡寿命长、耗能少.已知砷化镓的晶胞结构如图1所示.请回答下列问题:(1)下列说法正确的是
A.砷化镓晶胞结构与NaCl相同B.第一电离能As>GaC.电负性As>GaD.原子半径As>Ga
(2)砷化镓可由(CH3)3Ga和AsH3在700℃下反应制得,反应的化学方程式为
(3)AsH3空间形状为
Ⅱ.金属铜的导电性仅次于银,局金属中的第二位,大量用于电气工业.
(4)请解释金属铜能导电的原因
(5)在硫酸铜溶液中通入过量的氨气,小心蒸发,最终得到深蓝色的[Cu(NH3)4]SO4晶体,晶体中含有的化学键除普通共价键外,还有
(6)NiO晶体结构与NaCl晶体类似,其晶胞的棱长为acm,则该晶胞中距离最近的两个阳离子核间的距离为
考点:晶胞的计算
专题:化学键与晶体结构
分析:(1)A.对比GaAs与NaCl中阴阳离子在晶胞中的分布可判断晶胞结构是否一样;
B.同周期元素从左到右第一电离能逐渐增大;
C.同周期元素从左到右电负性逐渐增大;
D.同周期自左而右原子半径减小;
(2)砷化镓可由(CH3)3Ga和AsH3在700℃下反应制得,根据原子守恒可知还生成CH4;
(3)根据中心原子成键与含有孤电子对数判断分子的空间构型可杂化方式;
(4)根据金属晶体的构成微粒分析解答;根据能量最低原理书写电子排布式;
(5)[Cu(NH3)4]SO4晶体属于配合物,配离子与硫酸根之间形成离子键、铜离子与氨气分子之间形成配位键,氨气分子、硫酸根离子中存在普通共价键.
(6)根据氯化钠的结构知,氧离子和相邻的镍离子之间的距离为
a,距离最近的两个阳离子核间的距离是距离最近的氧离子和镍离子距离的
倍,根据图片知,每个氧化镍所占的面积=1.40×10-10m×1.40×10-10m×sin60°,每个氧化镍的质量=
g,每个氧化镍的质量乘以每平方米含有的氧化镍个数就是每平方米含有的氧化镍质量.
B.同周期元素从左到右第一电离能逐渐增大;
C.同周期元素从左到右电负性逐渐增大;
D.同周期自左而右原子半径减小;
(2)砷化镓可由(CH3)3Ga和AsH3在700℃下反应制得,根据原子守恒可知还生成CH4;
(3)根据中心原子成键与含有孤电子对数判断分子的空间构型可杂化方式;
(4)根据金属晶体的构成微粒分析解答;根据能量最低原理书写电子排布式;
(5)[Cu(NH3)4]SO4晶体属于配合物,配离子与硫酸根之间形成离子键、铜离子与氨气分子之间形成配位键,氨气分子、硫酸根离子中存在普通共价键.
(6)根据氯化钠的结构知,氧离子和相邻的镍离子之间的距离为
| 1 |
| 2 |
| 2 |
| 74.7 |
| NA |
解答:
解:(1)A.GaAs晶体中As分布于晶胞体心,Ga分布于顶点和面心,而NaCl中阴阳离子分别位于晶胞的顶点、面心以及棱和体心,二者结构不同,故A错误;
B.同周期元素从左到右第一电离能逐渐增大,则第一电离能:As>Ga,故B正确;
C.同周期元素从左到右电负性逐渐增大,则电负性:As>Ga,故C正确;
D.同周期自左而右原子半径减小,故原子半径As<Ga,故D错误,
故答案为:BC;
(2)反应为(CH3)3Ga和AsH3,生成为GaAs,根据原子守恒可知还应有和CH4,反应的化学方程式为(CH3)3Ga+AsH3
GaAs+3CH4,
故答案为:(CH3)3Ga+AsH3
GaAs+3CH4;
(3)AsH3中含有3个δ键和1个孤电子对,为三角锥形,(CH3)3Ga中Ga形成3个δ键,没有孤电子对,为sp2杂化,
故答案为:三角锥型;sp2;
(4)铜为金属晶体,由铜离子与自由电子构成,自由电子在外加电场的作用下可以发生定向移动,故可以导电,Cu2+的核外电子排布式为:1s22s22p63s23p63d9,
故答案为:铜为金属晶体,由铜离子与自由电子构成,自由电子在外加电场的作用下可以发生定向移动;1s22s22p63s23p63d9;
(5)[Cu(NH3)4]SO4晶体属于配合物,配离子与硫酸根之间形成离子键、铜离子与氨气分子之间形成配位键,)[Cu(NH3)4]SO4晶体属于配合物,氨气分子、硫酸根离子中存在普通共价键,四氨合铜络离子与硫酸根之间形成离子键、铜离子与氨气分子之间形成配位键,
故答案为:离子键;配位键;
(6)根据氯化钠的结构知,氧离子和相邻的镍离子之间的距离为
a,距离最近的两个阳离子核间的距离是距离最近的氧离子和镍离子距离的
倍,所以其距离是
acm;
根据图片知,每个氧化镍所占的面积=
,则每平方米含有的氧化镍个数=
,每个氧化镍的质量=
g,所以每平方米含有的氧化镍质量=
g×
=
=1.83×10-3,
故答案为:
a;
=1.83×10-3.
B.同周期元素从左到右第一电离能逐渐增大,则第一电离能:As>Ga,故B正确;
C.同周期元素从左到右电负性逐渐增大,则电负性:As>Ga,故C正确;
D.同周期自左而右原子半径减小,故原子半径As<Ga,故D错误,
故答案为:BC;
(2)反应为(CH3)3Ga和AsH3,生成为GaAs,根据原子守恒可知还应有和CH4,反应的化学方程式为(CH3)3Ga+AsH3
| ||
故答案为:(CH3)3Ga+AsH3
| ||
(3)AsH3中含有3个δ键和1个孤电子对,为三角锥形,(CH3)3Ga中Ga形成3个δ键,没有孤电子对,为sp2杂化,
故答案为:三角锥型;sp2;
(4)铜为金属晶体,由铜离子与自由电子构成,自由电子在外加电场的作用下可以发生定向移动,故可以导电,Cu2+的核外电子排布式为:1s22s22p63s23p63d9,
故答案为:铜为金属晶体,由铜离子与自由电子构成,自由电子在外加电场的作用下可以发生定向移动;1s22s22p63s23p63d9;
(5)[Cu(NH3)4]SO4晶体属于配合物,配离子与硫酸根之间形成离子键、铜离子与氨气分子之间形成配位键,)[Cu(NH3)4]SO4晶体属于配合物,氨气分子、硫酸根离子中存在普通共价键,四氨合铜络离子与硫酸根之间形成离子键、铜离子与氨气分子之间形成配位键,
故答案为:离子键;配位键;
(6)根据氯化钠的结构知,氧离子和相邻的镍离子之间的距离为
| 1 |
| 2 |
| 2 |
| ||
| 2 |
根据图片知,每个氧化镍所占的面积=
| 4×1.40×10-10m×8×1.40×10-10m×sin60° |
| 8 |
| 1 |
| 4×1.4×10-10×1.4×10-10Sin60° |
| 74.7 |
| NA |
| 74.7 |
| NA |
| 1 |
| 4×1.4×10-10×1.4×10-10Sin60° |
| 74.7 | ||||
6.02×1023×4×1.4×10-10×1.4×10-10×
|
故答案为:
| ||
| 2 |
| 74.7 | ||||
6.02×1023×4×1.4×10-10×1.4×10-10×
|
点评:本题考查学生对物质结构与性质模块的掌握情况,重点考查结构知识,涉及电离能、电负性、原子半径、空间结构、杂化轨道、化学式、金属晶体电子气理论,考查知识全面、覆盖广,难度适中,可以衡量学生对该模块主干知识的掌握情况.

练习册系列答案
 优加精卷系列答案
优加精卷系列答案
相关题目
在水中加入下列物质,可使水的电离平衡向右移动的是( )
| A、硫酸 | B、氢氧化钾 |
| C、氯化铁 | D、硝酸钡 |
用NA表示阿伏加德罗常数,下列有关叙述错误的是( )
| A、臭氧与氧气的混合气体4.8g中所含有的原子总数为0.3NA |
| B、标准状况下,2.24L单质气体中含有原子数为0.2NA |
| C、在常温常压下,3.4gNH3含有的电子数是2NA |
| D、含5.4 gAl3+的硫酸铝溶液中,含有的SO42-的数目是0.3NA |
一定条件下,在体积为3L的密闭容器中,发生反应:CO(g)+2H2(g)?CH3OH(g),在不同温度下甲醇的物质的量随时间的变化如图所示,下列叙述真确的是( )
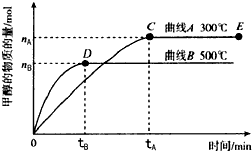

| A、平衡常数K(300℃)小于K(500℃) | ||
| B、在其他条件下不变时,压缩处于E点的体系体积,甲醇浓度增大 | ||
| C、300℃,当容器内气体密度不变时说明反应已经达到平衡 | ||
D、500℃,从反应开始到平衡,氨气的平均反应速率v(H2)=
|
 某同学对Cl2与KI溶液的反应进行了实验探究.反应装置如下:
某同学对Cl2与KI溶液的反应进行了实验探究.反应装置如下:



 +CH3Cl
+CH3Cl -CH3+HCl
-CH3+HCl
 (1R、R2代表羟基)
(1R、R2代表羟基) 结构;②能与FeCl3溶液发生显色反应,共有
结构;②能与FeCl3溶液发生显色反应,共有