题目内容
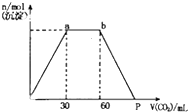 向Ba(OH)2和KOH混合液中缓缓通入CO2气体至过量,生成沉淀物质的量与通入CO2气体体积VmL的关系如图所示,下列结论中正确的是( )
向Ba(OH)2和KOH混合液中缓缓通入CO2气体至过量,生成沉淀物质的量与通入CO2气体体积VmL的关系如图所示,下列结论中正确的是( )| A、原混合物中n[Ba(OH)2]:n(KOH)=1:2 |
| B、p点坐标为120mL |
| C、p点溶液中溶质为Ba(HCO3)2 |
| D、a,b段反应分二阶段,离子方程式为:CO2+2OH-=CO32-+H2O CO32-+H2O+CO2=2HCO3- |
考点:离子方程式的有关计算
专题:压轴题,计算题
分析:向KOH和Ba(OH)2的混合稀溶液中通入CO2,先二氧化碳和氢氧化钡反应生成碳酸钡沉淀,当氢氧化钡消耗完时,继续通入二氧化碳,二氧化碳和氢氧化钾反应生成碳酸钾,当氢氧化钾完全反应后,
继续通入二氧化碳,二氧化碳和碳酸钾、水反应生成碳酸氢钾,当碳酸钾反应后,继续通入二氧化碳,二氧化碳和和碳酸钡、水反应生成可溶性的碳酸氢钡.
A.根据OA段:Ba2++2OH-+CO2═BaCO3↓+H2O,ab段:2OH-+CO2═CO32-+H2O、CO32-+H2O+CO2=2HCO3-分析解答;
B.根据OA段:Ba2++2OH-+CO2═BaCO3↓+H2O,bp段:最后是BaCO3+CO2+H2O═Ba2++2HCO3-分析解答;
C.p点溶液中溶质为Ba(HCO3)2、KHCO3;
D.a,b段反应分二阶段,先是二氧化碳和氢氧化钾反应生成碳酸钾,后是二氧化碳和碳酸钾、水反应生成碳酸氢钾;
继续通入二氧化碳,二氧化碳和碳酸钾、水反应生成碳酸氢钾,当碳酸钾反应后,继续通入二氧化碳,二氧化碳和和碳酸钡、水反应生成可溶性的碳酸氢钡.
A.根据OA段:Ba2++2OH-+CO2═BaCO3↓+H2O,ab段:2OH-+CO2═CO32-+H2O、CO32-+H2O+CO2=2HCO3-分析解答;
B.根据OA段:Ba2++2OH-+CO2═BaCO3↓+H2O,bp段:最后是BaCO3+CO2+H2O═Ba2++2HCO3-分析解答;
C.p点溶液中溶质为Ba(HCO3)2、KHCO3;
D.a,b段反应分二阶段,先是二氧化碳和氢氧化钾反应生成碳酸钾,后是二氧化碳和碳酸钾、水反应生成碳酸氢钾;
解答:
解:A.OA段:Ba2++2OH-+CO2═BaCO3↓+H2O,消耗30mL的二氧化碳、ab段:2OH-+CO2═CO32-+H2O、ab段消耗(60-30)mL的二氧化碳;bp段:最后是BaCO3+CO2+H2O═Ba2++2HCO3-,由Oa段和ac段的反应原理可知,消耗二氧化碳的量Ba(OH)2和KOH的物质的量相等,所以原混合溶液中Ba(OH)2和KOH的物质的量之比为30:(60-30)=1:1,故A错误;
B.OA段:Ba2++2OH-+CO2═BaCO3↓+H2O,消耗30mL的二氧化碳,bp段:最后是BaCO3+CO2+H2O═Ba2++2HCO3-,需消耗30mL的二氧化碳,所以P点为90mL,故B错误;
C.ab段:2OH-+CO2═CO32-+H2O、CO32-+H2O+CO2=2HCO3-,最后是BaCO3+CO2+H2O═Ba2++2HCO3-,所以p点溶液中溶质为Ba(HCO3)2、KHCO3,故C错误;
D.a,b段,当氢氧化钡消耗完时,继续通入二氧化碳,二氧化碳和氢氧化钾反应生成碳酸钾,CO2+2OH-=CO32-+H2O,继续通入二氧化碳,二氧化碳和碳酸钾、水反应生成碳酸氢钾,CO32-+H2O+CO2=2HCO3-,故D正确;
故选D.
B.OA段:Ba2++2OH-+CO2═BaCO3↓+H2O,消耗30mL的二氧化碳,bp段:最后是BaCO3+CO2+H2O═Ba2++2HCO3-,需消耗30mL的二氧化碳,所以P点为90mL,故B错误;
C.ab段:2OH-+CO2═CO32-+H2O、CO32-+H2O+CO2=2HCO3-,最后是BaCO3+CO2+H2O═Ba2++2HCO3-,所以p点溶液中溶质为Ba(HCO3)2、KHCO3,故C错误;
D.a,b段,当氢氧化钡消耗完时,继续通入二氧化碳,二氧化碳和氢氧化钾反应生成碳酸钾,CO2+2OH-=CO32-+H2O,继续通入二氧化碳,二氧化碳和碳酸钾、水反应生成碳酸氢钾,CO32-+H2O+CO2=2HCO3-,故D正确;
故选D.
点评:本题考查物质之间的反应,明确物质的性质、及反应先后顺序是解本题关键,题目难度中等.

练习册系列答案
 夺冠金卷全能练考系列答案
夺冠金卷全能练考系列答案
相关题目
在水中加入下列物质,可使水的电离平衡向右移动的是( )
| A、硫酸 | B、氢氧化钾 |
| C、氯化铁 | D、硝酸钡 |
下列说法正确的是( )
| A、已知氢元素有1H、2H、3H三种同位素,氧元素有16O、18O两种同位素,则它们之间形成的化合物有30种 | ||||||||
| B、能够使pH试纸显红色的溶液pH一定大于7 | ||||||||
| C、已知反应:2(CaO?MgO)(s)+Si(s)?CaSiO4(l)+2Mg(g),在密闭的还原炉内达到平衡后,若其他条件均不改变,将还原炉体积缩小一半,则达到新平衡是Mg(g)的浓度将升高 | ||||||||
D、
|
漂白粉在溶液中存在下列平衡:ClO-+H2O?HClO+OH-,下列措施能提高其漂白性能的是( )
| A、加水稀释 |
| B、加少量NaOH |
| C、加适量氢碘酸 |
| D、通入CO2 |
被称之为“软电池”的纸质电池,采用一个薄层纸片作为传导体,在其一边镀锌,而在其另一边镀二氧化锰.在纸内的离子“流过”水和氧化锌组成的电解液.电池总反应为:Zn+2MnO2十H2O═ZnO+2MnO (OH).下列说法正确的是( )
| A、该电池的正极为锌 |
| B、电池正极反应式为:2MnO2+2e-+2H2O═2MnO (OH)+2OH- |
| C、当 0.l mol Zn 完全溶解时,流经电解液的电子个数为 1.204×l023 |
| D、该电池反应中二氧化锰起催化剂作用 |
用NA表示阿伏加德罗常数,下列有关叙述错误的是( )
| A、臭氧与氧气的混合气体4.8g中所含有的原子总数为0.3NA |
| B、标准状况下,2.24L单质气体中含有原子数为0.2NA |
| C、在常温常压下,3.4gNH3含有的电子数是2NA |
| D、含5.4 gAl3+的硫酸铝溶液中,含有的SO42-的数目是0.3NA |
 (1)含有弱酸HA和其钠盐NaA的混合溶液,在化学上用作缓冲溶液.向其中加入少量酸或碱时,溶液的酸碱性变化不大.现将0.04mol?L-1HA溶液和0.02mol?L-1NaOH溶液等体积混合,得到缓冲溶液.
(1)含有弱酸HA和其钠盐NaA的混合溶液,在化学上用作缓冲溶液.向其中加入少量酸或碱时,溶液的酸碱性变化不大.现将0.04mol?L-1HA溶液和0.02mol?L-1NaOH溶液等体积混合,得到缓冲溶液.