题目内容
5.A、B、C、D、E、F六种短周期元素的原子序数依次增大.A、D同族,B、C同周期;C是F不同周期的邻族元素;B原子最外层电子数比其次外层电子数多2;B、A两元素的核电荷数之差等于它们的原子最外层电子数之和;E和F的原子序数之和为30.由上述六种元素中的两种元素组成的甲、乙、丙、丁、戊、己六种化合物如表所示:| 化合物 | 甲 | 乙 | 丙 |
| 各元素原子个数比 | N(A):N(C)=2:1 | N(A):N(C)=1:1 | N(B):N(A)=1:4 |
| 化合物 | 丁 | 戊 | 己 |
| 各元素原子个数比 | N(D):N(C)=1:1 | N(E):N(F)=1:3 | N(B):N(F)=1:4 |
(1)化合物己的化学式为CCl4,每个乙分子含有1个非极性键.
(2)向含有1mol乙的水溶液中加入MnO2,该反应中电子转移的物质的量为1mol.
(3)丙分子的结构式为
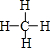 .
.(4)戊在水溶液中电离出的阳离子的结构示意图为
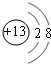 .
.(5)丁与水发生反应的离子方程式为2Na2O2+2H2O=4Na++4OH-+O2↑.
分析 A、B、C、D、E、F六种短周期元素,它们的原子序数依次增大,B原子最外层电子数比其次外层电子数多2,B原子只能有2个电子层,最外层电子数为4,则B为碳元素;A、B两元素的核电荷数之差等于它们的原子最外层电子数之和,A与B不可能处于同周期,则A为H元素;A与D同主族,结合原子序数可知D为Na;B、C同周期,即处于第二周期,由甲、乙及丁中原子数目之比,可知C为O元素;E、F处于第三周期,C是F不同周期的邻族元素,E和F的原子序数之和为30,则E为Al,F为Cl.故甲为H2O,乙为H2O2,丙为CH4,丁为Na2O2,戊为AlCl3,己为CCl4,据此解答.
解答 解:A、B、C、D、E、F六种短周期元素,它们的原子序数依次增大,B原子最外层电子数比其次外层电子数多2,B原子只能有2个电子层,最外层电子数为4,则B为碳元素;A、B两元素的核电荷数之差等于它们的原子最外层电子数之和,A与B不可能处于同周期,则A为H元素;A与D同主族,结合原子序数可知D为Na;B、C同周期,即处于第二周期,由甲、乙及丁中原子数目之比,可知C为O元素;E、F处于第三周期,C是F不同周期的邻族元素,E和F的原子序数之和为30,则E为Al,F为Cl.故甲为H2O,乙为H2O2,丙为CH4,丁为Na2O2,戊为AlCl3,己为CCl4.
(1)化合物己的化学式为CCl4,乙为H2O2,结构式为H-O-O-H,每个乙分子含有1个非极性键,
故答案为:CCl4;1;
(2)向含有1molH2O2的水溶液中加入MnO2,发生反应:2H2O2$\frac{\underline{\;MnO_{2}\;}}{\;}$2H2O+O2↑,生成氧气为0.5mol,该反应中电子转移的物质的量为0.5mol×2=1mol,
故答案为:1;
(3)丙为CH4,分子的结构式为: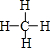 ,
,
故答案为: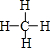 ;
;
(4)戊为AlCl3,戊在水溶液中电离出的阳离子的结构示意图为 ,
,
故答案为: ;
;
(5)丁为Na2O2,与水发生反应的离子方程式为:2Na2O2+2H2O=4Na++4OH-+O2↑,
故答案为:2Na2O2+2H2O=4Na++4OH-+O2↑.
点评 本题考查元素化合物推断、常用化学用语、氧化还原反应等,熟练掌握元素化合物的组成,注意基础知识的全面掌握.

 轻巧夺冠周测月考直通高考系列答案
轻巧夺冠周测月考直通高考系列答案| A. | 相同物质的量浓度的Na2Y和NaHY溶液,前者的pH大于后者 | |
| B. | NaHY的溶液中,离子浓度大小顺序为:c(Na+)>c(Y-)>c(HY-)>c(OH-)>c(H+) | |
| C. | HY-的水解离子方程式为:HY-+H2O?Y-+H3O+ | |
| D. | 在Na2Y、NaHY、H2Y的溶液中,阴离子的种类不同 |
| A. | ⅠA元素的电负性从上到下逐渐增大,而ⅦA元素的电负性从上到下逐渐减小 | |
| B. | 电负性的大小可以作为衡量元素的金属性和非金属性强弱的尺度 | |
| C. | 氢原子中只有一个电子,故氢原子只有一个原子轨道 | |
| D. | NaH的存在能支持可将氢元素放在ⅦA的观点 |
| A. | 最易失去的电子能量最高 | |
| B. | 电离能最小的电子能量最高 | |
| C. | 2p轨道电子能量高于2s轨道电子能量 | |
| D. | 在离核最近区域内运动的电子能量最高 |
| A. | 原子及其离子核外电子层数等于该元素所在的周期数 | |
| B. | 元素周期表中从ⅢB族到ⅡB族10个纵行的元素都是金属元素 | |
| C. | 除氦外的稀有气体原子的最外层电子数都是8 | |
| D. | 质子数相同、电子数也相同的两种微粒,不可能是一种分子和一种离子 |
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ |
(2)在最高价氧化物的水化物中,酸性最强的化合物的分子式是HClO4,碱性最强的化合物的电子式是:
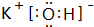 .
.(3)写出元素①对应的最高价氧化物的结构式为O=C=O该氧化物的晶体中含有的作用力是 (填离子键或共价键或分子间作用力)共价键、分子间作用力
(4)①②③⑥这四种元素对应的简单氢化物沸点最高的是H2O>NH3>H2S>CH4
(5)③④⑤⑥这四种元素对应的离子半径由大到小的顺序S2->O2->Na+>Al3+.
 ,名称为2,3-二甲基-2-丁烯.A中的碳原子是否都处于同一平面?是(填“是”或“不是”).
,名称为2,3-二甲基-2-丁烯.A中的碳原子是否都处于同一平面?是(填“是”或“不是”).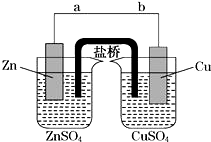 某学生利用如图实验装置探究盐桥式原电池的工作原理(Cu元素的相对原子质量为64).按照实验步骤依次回答下列问题:
某学生利用如图实验装置探究盐桥式原电池的工作原理(Cu元素的相对原子质量为64).按照实验步骤依次回答下列问题:
 .
.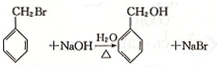 .
.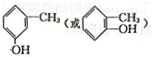 .
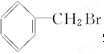
.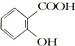 )的原料,其合成过程如下:
)的原料,其合成过程如下: