题目内容
10.下列说法错误的是( )| A. | 原子及其离子核外电子层数等于该元素所在的周期数 | |
| B. | 元素周期表中从ⅢB族到ⅡB族10个纵行的元素都是金属元素 | |
| C. | 除氦外的稀有气体原子的最外层电子数都是8 | |
| D. | 质子数相同、电子数也相同的两种微粒,不可能是一种分子和一种离子 |
分析 A、主族元素的金属阳离子的电子层数不等于该元素所在周期数;
B、元素周期表中从 IIIB到 IIB族10个纵行包括副族元素和第ⅤⅢ族;
C、稀有气体性质稳定,最外层电子数为8;
D、离子带电荷,质子数一定不等于电子数;分子不带电,质子数等于电子数.
解答 解:A、原子的核外电子层数等于该元素所在的周期数,但主族元素的金属阳离子的电子层数不等于该元素所在周期数,如钠离子有2个电子层,但钠在第三周期,故A错误;
B、元素周期表中从 IIIB到 IIB族10个纵行包括副族元素和第ⅤⅢ族,为过渡元素,都是金属元素,故B正确;
C、稀有气体性质稳定,最外层电子数为8,为稳定结构,只有He(最外层2个电子)例外,故C正确;
D、离子带电荷,质子数一定不等于电子数;分子不带电,质子数等于电子数,所以质子数相同、电子数也相同的两种微粒,不可能是一种分子和一种离子,故D正确;
故选A.
点评 本题考查元素周期表的结构及元素在周期表中的位置,熟悉元素的位置及原子结构的关系、同周期元素的变化规律即可解答,难度不大.

练习册系列答案
相关题目
20.下列关于元素周期表的说法正确的是( )
| A. | 过渡元素全部都是副族元素 | |
| B. | 短周期共有32种元素 | |
| C. | 元素周期表共七个横行代表七个周期,18个纵行代表18个族 | |
| D. | 主族元素原子的最外层电子数等于该元素所属的族序数 |
1.已知:1molICl(s)被H2(g)完全还原为I2(s)和HCl(g)时,放出109kJ的热量,反应机理如下:
①H2+ICl→HI+HCl 慢反应
②HI+ICl→I2+HCl 快反应
下列说法正确的是( )
①H2+ICl→HI+HCl 慢反应
②HI+ICl→I2+HCl 快反应
下列说法正确的是( )
| A. | ICl中I显-1价 | |
| B. | HI是反应的中间产物 | |
| C. | 总反应速率的快慢主要由反应②决定 | |
| D. | 总反应的热化学方程式为H2(g)+2ICl(s)=I2(s)+2HCl(g)△H=-109kJ•mol-1 |
18.X、Y、Z、W均为短周期元素,他们在元素周期表的位置如图所示.若Y原子的最外层电子数与电子总数之比为3:4,下列说法正确的是( )
| X | Y | |
| Z | W |
| A. | 原子半径:W>Z>Y>X | |
| B. | 最高价氧化物对应水化物的酸性:Z>W>X | |
| C. | 气态氢化物的稳定性:Z>W | |
| D. | W的单质能与水反应,生成一种具有漂白性的物质 |
5.A、B、C、D、E、F六种短周期元素的原子序数依次增大.A、D同族,B、C同周期;C是F不同周期的邻族元素;B原子最外层电子数比其次外层电子数多2;B、A两元素的核电荷数之差等于它们的原子最外层电子数之和;E和F的原子序数之和为30.由上述六种元素中的两种元素组成的甲、乙、丙、丁、戊、己六种化合物如表所示:
请回答下列问题:
(1)化合物己的化学式为CCl4,每个乙分子含有1个非极性键.
(2)向含有1mol乙的水溶液中加入MnO2,该反应中电子转移的物质的量为1mol.
(3)丙分子的结构式为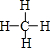 .
.
(4)戊在水溶液中电离出的阳离子的结构示意图为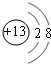 .
.
(5)丁与水发生反应的离子方程式为2Na2O2+2H2O=4Na++4OH-+O2↑.
| 化合物 | 甲 | 乙 | 丙 |
| 各元素原子个数比 | N(A):N(C)=2:1 | N(A):N(C)=1:1 | N(B):N(A)=1:4 |
| 化合物 | 丁 | 戊 | 己 |
| 各元素原子个数比 | N(D):N(C)=1:1 | N(E):N(F)=1:3 | N(B):N(F)=1:4 |
(1)化合物己的化学式为CCl4,每个乙分子含有1个非极性键.
(2)向含有1mol乙的水溶液中加入MnO2,该反应中电子转移的物质的量为1mol.
(3)丙分子的结构式为
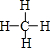 .
.(4)戊在水溶液中电离出的阳离子的结构示意图为
 .
.(5)丁与水发生反应的离子方程式为2Na2O2+2H2O=4Na++4OH-+O2↑.
15.几种短周期元素的原子半径及主要化合价见下表:
下列叙述正确的是( )
| 元素代号 | A | L | M | Q | R | T | N |
| 原子半径/nm | 0.183 | 0.160 | 0.143 | 0.102 | 0.089 | 0.074 | 0.152 |
| 主要化合价 | +1 | +2 | +3 | +6、-2 | +2 | -2 | +1 |
| A. | A、L、M三元素的金属性逐渐增强 | |
| B. | 在RCl2分子中,各原子均满足8电子的稳定结构 | |
| C. | Q元素的最高价氧化物为电解质,其水溶液能够导电 | |
| D. | A在T单质中燃烧所形成的化合物中含有共价键和离子键 |
20.下列化学用语表示正确的是( )
| A. | 氯气的电子式:Cl:Cl | |
| B. | 硫酸铵的电离方程式:Na2SO4═Na++SO42- | |
| C. | 钠原子的结构示意图: | |
| D. | NH3分子的比例模型: |
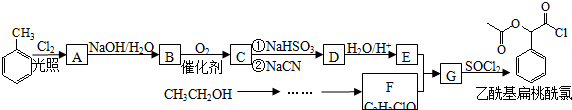
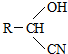 ,RCN$\stackrel{H_{2}O/H+}{→}$RCOOH,RCOOH$\stackrel{SOCl_{2}}{→}$RCOCl$\stackrel{R′OH}{→}$RCOOR′
,RCN$\stackrel{H_{2}O/H+}{→}$RCOOH,RCOOH$\stackrel{SOCl_{2}}{→}$RCOCl$\stackrel{R′OH}{→}$RCOOR′ .
. .
. .
.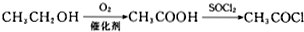 .
.