题目内容
17.下表是元素周期表的一部分,据表中的①~⑨种元素填写下列空白:(填具体元素相应的符号).| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ |
(2)在最高价氧化物的水化物中,酸性最强的化合物的分子式是HClO4,碱性最强的化合物的电子式是:
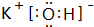 .
.(3)写出元素①对应的最高价氧化物的结构式为O=C=O该氧化物的晶体中含有的作用力是 (填离子键或共价键或分子间作用力)共价键、分子间作用力
(4)①②③⑥这四种元素对应的简单氢化物沸点最高的是H2O>NH3>H2S>CH4
(5)③④⑤⑥这四种元素对应的离子半径由大到小的顺序S2->O2->Na+>Al3+.
分析 由元素在周期表中位置,可知①为C、②为N、③为O、④为Na、⑤为Al、⑥为S、⑦为Cl、⑧为Ar、⑨为K.
(1)稀有气体原子最外层为稳定结构,化学性质最不活泼;
(2)高氯酸的酸性最强;K的金属性最强,故KOH的碱性最强,由钾离子与氢氧根离子构成;
(3)元素①对应的最高价氧化物为CO2,分子碳原子与氧原子之间形成2对共用电子对;
(4)常温下水为液态,其它为气体,水的沸点最高,其它三种中,分子中形成氢键,沸点相对较高,而相对分子质量越大,分子间作用力越大,沸点越高;
(5)离子电子层结构相同,核电荷数越大离子半径越小,离子电子层越多离子半径越大.
解答 解:由元素在周期表中位置,可知①为C、②为N、③为O、④为Na、⑤为Al、⑥为S、⑦为Cl、⑧为Ar、⑨为K.
(1)稀有气体原子最外层为稳定结构,Ar化学性质最不活泼,故答案为:Ar;
(2)高氯酸的酸性最强,化学式为HClO4;上述元素中K的金属性最强,故碱性最强的为KOH,电子式为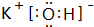 ,故答案为:HClO4;
,故答案为:HClO4;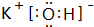 ;
;
高氯酸的酸性最强;K的金属性最强,故KOH的碱性最强,由钾离子与氢氧根离子构成;
(3)元素①对应的最高价氧化物为CO2,分子碳原子与氧原子之间形成2对共用电子对,结构式为O=C=O,晶体中含有的作用力是:共价键、分子间作用力,
故答案为:O=C=O;共价键、分子间作用力;
(4)常温下水为液态,其它为气体,水的沸点最高,其它三种中,NH3分子之间形成氢键,沸点相对较高,CH4、H2S中H2S的相对分子质量越大,分子间作用力越大,沸点较高,故沸点:H2O>NH3>H2S>CH4,
故答案为:H2O>NH3>H2S>CH4;
(5)离子电子层结构相同,核电荷数越大离子半径越小,离子电子层越多离子半径越大,故离子半径:S2->O2->Na+>Al3+,
故答案为:S2->O2->Na+>Al3+.
点评 本题考查元素周期表与元素周期律的综合应用,需要学生熟练掌握周期表的结构、熟记元素符号,注意氢键对物质性质的影响,掌握微粒半径比较规律.

| 化合物 | 甲 | 乙 | 丙 |
| 各元素原子个数比 | N(A):N(C)=2:1 | N(A):N(C)=1:1 | N(B):N(A)=1:4 |
| 化合物 | 丁 | 戊 | 己 |
| 各元素原子个数比 | N(D):N(C)=1:1 | N(E):N(F)=1:3 | N(B):N(F)=1:4 |
(1)化合物己的化学式为CCl4,每个乙分子含有1个非极性键.
(2)向含有1mol乙的水溶液中加入MnO2,该反应中电子转移的物质的量为1mol.
(3)丙分子的结构式为
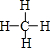 .
.(4)戊在水溶液中电离出的阳离子的结构示意图为
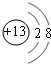 .
.(5)丁与水发生反应的离子方程式为2Na2O2+2H2O=4Na++4OH-+O2↑.
| A. | 具有下列电子排布式的原子中,①1s22s22p63s23p2②1s22s22p3 ③1s22s22p2 ④1s22s22p63s23p4 原子半径最大的是① | |
| B. | 具有下列价电子排布式的原子中,①3s23p1 ②3s23p2 ③3s23p3 ④3s23p4,第一电离能最大的是③ | |
| C. | ①Na、K、Rb ②O、S、Se ③Na、P、Cl,元素的电负性随原子序数增大而递增的是③ | |
| D. | 某元素气态基态原子的逐级电离能分别为738、1451、7733、10540、13630、17995、21703,当它与氯气反应时可能生成的阳离子是X3+ |
| A. | 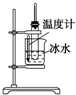 实验室制取少量的硝基苯 | |
| B. | 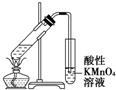 证明溴乙烷、NaOH、乙醇溶液共热生成乙烯 | |
| C. | 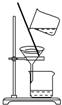 分离乙酸乙酯、碳酸钠和水的混合物 | |
| D. | 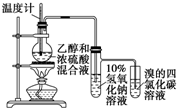 证明乙醇、浓硫酸共热生成乙烯 |
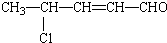 ,该有机物可能发生的反应( )
,该有机物可能发生的反应( )①氧化 ②取代 ③加成 ④消去 ⑤还原 ⑥酯化 ⑦水解 ⑧加聚.
| A. | ①②③④⑦⑧ | B. | ①②③④⑤⑦⑧ | C. | ①②③④⑤⑦ | D. | ②③④⑤⑦⑧ |
| A | C | |
| B |
| A. | A为VB族元素 | |
| B. | B为第二周期的元素 | |
| C. | 三种元素都为金属元素 | |
| D. | C元素单质是化学性质最活泼的非金属 |
 分子式为CmH20的烷烃中m为9,分子中含有22个共价键的烷烃的分子式:C7H16,与CO2的密度(同温同压)相同的烷烃分子式为的C3H8.若上述四种烃各为1mol,在足量O2中燃烧,消耗O2最多的是(填分子式)C9H20.
分子式为CmH20的烷烃中m为9,分子中含有22个共价键的烷烃的分子式:C7H16,与CO2的密度(同温同压)相同的烷烃分子式为的C3H8.若上述四种烃各为1mol,在足量O2中燃烧,消耗O2最多的是(填分子式)C9H20.
 .
. .
.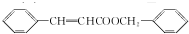 ,下列关于X的说法不正确的是bc(填字母).
,下列关于X的说法不正确的是bc(填字母). 或
或 (填结构简式).
(填结构简式).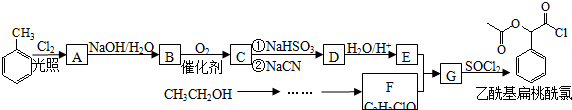
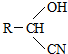 ,RCN$\stackrel{H_{2}O/H+}{→}$RCOOH,RCOOH$\stackrel{SOCl_{2}}{→}$RCOCl$\stackrel{R′OH}{→}$RCOOR′
,RCN$\stackrel{H_{2}O/H+}{→}$RCOOH,RCOOH$\stackrel{SOCl_{2}}{→}$RCOCl$\stackrel{R′OH}{→}$RCOOR′ .
. .
. .
.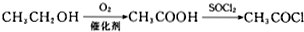 .
.