题目内容
14.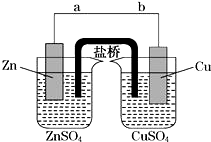 某学生利用如图实验装置探究盐桥式原电池的工作原理(Cu元素的相对原子质量为64).按照实验步骤依次回答下列问题:
某学生利用如图实验装置探究盐桥式原电池的工作原理(Cu元素的相对原子质量为64).按照实验步骤依次回答下列问题:(1)导线中电子流向为a→b(用a、b表示).
(2)若装置中铜电极的质量增加0.64g,则导线中转移的电子数目为0.02NA (用“NA”表示);
(3)装置中盐桥中除添加琼脂外,还要添加KCl的饱和溶液,电池工作时,对盐桥中的K+、Cl-的移动方向的表述正确的是B.
A.盐桥中的K+向左侧烧杯移动、Cl-向右侧烧杯移动
B.盐桥中的K+向右侧烧杯移动、Cl-向左侧烧杯移动
C.盐桥中的K+、Cl-都向左侧烧杯移动
D.盐桥中的K+、Cl-几乎都不移动
(4)若将反应2Fe3++Cu═Cu2++2Fe2+设计成原电池,写出电极反应式.正极反应2Fe3++2e-=2Fe2+;
(5)下列是用化学方程式表示的化学变化,请在每小题后的横线上注明能量的转化形式.
①电池总反应:Zn+Ag2O+H2O═Zn(OH)2+2Ag:化学能转化为电能.
②2C2H2+5O2$\stackrel{点燃}{→}$4CO2+2H2O:化学能转化为热能.
③6H2O+6CO2$→_{叶绿体}^{光}$C6H12O6(葡萄糖)+6O2:太阳能(光能)转化为化学能.
分析 (1)根据金属活泼性判断正负极,原电池中,电子由负极流向正极;
(2)根据电极反应式进行相关计算,得出正确结论;
(3)根据正负极判断阴阳离子的移动方向;
(4)由方程式可知,Cu被氧化,为原电池的负极,则正极可为碳棒或不如Cu活泼的金属,电解质溶液为氯化铁溶液,正极发生还原反应,负极发生氧化反应,据此解答;
(5)从反应条件可判断能量的转化形式.
解答 解:(1)锌铜原电池中,锌比铜活泼,故锌为负极,铜为正极.原电池中,电子由负极流向正极,故电子的流向为a→b,
故答案为:a→b;
(2)0.64g铜物质的量为0.01mol,由电极反应式Cu2++2e-=Cu可知,生成1mol铜,转移2mol电子,故生成0.01mol铜,导线中转移0.02mol电子,电子数目为0.02NA,
故答案为:0.02NA ;
(3)左侧烧杯中锌失电子变成锌离子,使得锌电极附近带正电荷,吸引阴离子向左侧烧杯移动,右侧烧杯中铜离子得到电子变成铜,使得铜电极附近带负电荷,吸引阳离子向右侧烧杯移动,故盐桥中的K+向右侧烧杯移动、Cl-向左侧烧杯移动,
故答案为:B;
(4)由方程式2Fe3++Cu═Cu2++2Fe2+可知,Cu被氧化,为原电池的负极,负极反应为Cu-2e-=Cu2+,正极Fe3+被还原,电极方程式为2Fe3++2e-=2Fe2+,
故答案为:2Fe3++2e-=2Fe2+;
(5)①放电是通过原电池装置把化学能转化为电能,故答案为:化学能转化为电能;
②燃烧是剧烈的氧化还原反应,把化学能转化为热能,故答案为:化学能转化为热能;
③绿色植物在叶绿体内,吸收和利用光能把二氧化碳和水合成葡萄糖,同时放出氧气,故答案为:太阳能(光能)转化为化学能.
点评 本题主要考查了原电池设计、工作原理、物质的量的相关计算、常见的能量转化形式,明确原电池原理是解本题关键,再根据方程式中元素化合价变化确定正负极材料及电解质溶液,同时考查学生分析问题、解决问题的能力,题目难度中等.

| 化合物 | 甲 | 乙 | 丙 |
| 各元素原子个数比 | N(A):N(C)=2:1 | N(A):N(C)=1:1 | N(B):N(A)=1:4 |
| 化合物 | 丁 | 戊 | 己 |
| 各元素原子个数比 | N(D):N(C)=1:1 | N(E):N(F)=1:3 | N(B):N(F)=1:4 |
(1)化合物己的化学式为CCl4,每个乙分子含有1个非极性键.
(2)向含有1mol乙的水溶液中加入MnO2,该反应中电子转移的物质的量为1mol.
(3)丙分子的结构式为
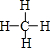 .
.(4)戊在水溶液中电离出的阳离子的结构示意图为
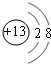 .
.(5)丁与水发生反应的离子方程式为2Na2O2+2H2O=4Na++4OH-+O2↑.
| A. |  实验室制取少量的硝基苯 | |
| B. | 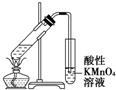 证明溴乙烷、NaOH、乙醇溶液共热生成乙烯 | |
| C. | 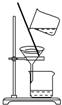 分离乙酸乙酯、碳酸钠和水的混合物 | |
| D. | 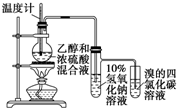 证明乙醇、浓硫酸共热生成乙烯 |
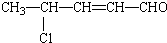 ,该有机物可能发生的反应( )
,该有机物可能发生的反应( )①氧化 ②取代 ③加成 ④消去 ⑤还原 ⑥酯化 ⑦水解 ⑧加聚.
| A. | ①②③④⑦⑧ | B. | ①②③④⑤⑦⑧ | C. | ①②③④⑤⑦ | D. | ②③④⑤⑦⑧ |
| A. | 混合物中一定含有甲醛 | |
| B. | 混合物中醛和醇的质量比可能为5:3 | |
| C. | 混合物中一定含有乙醛 | |
| D. | 混合物中一定含有乙醇 |
| A. | 原子核外的电子像云雾一样笼罩在原子核周围,故称电子云 | |
| B. | s轨道呈球形,处在该轨道上的电子只能在球壳内运动 | |
| C. | p轨道呈哑铃形,在空间有两个伸展方向 | |
| D. | 与s电子原子轨道相同,p电子原子轨道的平均半径随能层的增大而增大 |
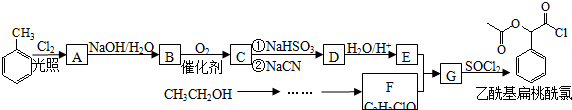
 ,RCN$\stackrel{H_{2}O/H+}{→}$RCOOH,RCOOH$\stackrel{SOCl_{2}}{→}$RCOCl$\stackrel{R′OH}{→}$RCOOR′
,RCN$\stackrel{H_{2}O/H+}{→}$RCOOH,RCOOH$\stackrel{SOCl_{2}}{→}$RCOCl$\stackrel{R′OH}{→}$RCOOR′ .
. .
. .
.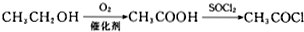 .
.