题目内容
5.用NA表示阿伏加德罗常数,下列说法正确的是( )| A. | 1L1mol•L-1的FeCl3溶液中Fe3+的数目为NA | |
| B. | 32g甲烷中含有2NA个C-H键 | |
| C. | 1molNH2-含有10NA个电子 | |
| D. | 1molNa2O2与足量CO2反应.转移电子数为2NA |
分析 A、铁离子为弱碱阳离子,在溶液中会水解;
B、求出甲烷的物质的量,然后根据甲烷中含4条C-H键来分析;
C、NH2-中含10个电子;
D、过氧化钠和二氧化碳反应时,1mol过氧化钠转移1mol电子.
解答 解:A、铁离子为弱碱阳离子,在溶液中会水解,故溶液中含有的铁离子的个数小于NA个,故A错误;
B、32g甲烷的物质的量为2mol,而甲烷中含4条C-H键,故2mol甲烷中含8NA条C-H键,故B错误;
C、NH2-中含10个电子,故1molNH2-中含10NA个电子,故C正确;
D、过氧化钠和二氧化碳反应时,1mol过氧化钠转移1mol电子,即转移NA个,故D错误.
故选C.
点评 本题考查了阿伏伽德罗常数的有关计算,难度不大,应注意掌握公式的运用和物质的结构.

练习册系列答案
相关题目
16.工业纯碱中常含有少量的NaCl杂质,某化学兴趣小组取m g纯碱样品与足量稀盐酸充分反应,加热、蒸干、灼烧,得ng固体.则该样品中纯碱的质量分数为( )
| A. | $\frac{106(m-n)}{11m}$×100% | B. | $\frac{168(m-n)}{56m}$×100% | C. | $\frac{84(n-m)?}{11m}$×100% | D. | $\frac{?(n-m)?}{m}$×100% |
13.设NA表示阿伏加德罗常数的数值,下列说法正确的是( )
| A. | 将1 molNH3通入水中得到1L溶液,则NH4+与NH3•H2O粒子总数为NA | |
| B. | 1.2 g NaHSO4晶体中含有离子总数为0.03 NA | |
| C. | 标准状况下,2.24 L SO3含有的分子数为0.1 NA | |
| D. | 14 g乙烯和环丙烷(C3H6)混合气体中的碳原子数为NA |
20.下列说法正确的是( )
| A. | 淀粉水解的最终产物是麦芽糖 | |
| B. | 丙烯分子中三个碳原子处于同一直线上 | |
| C. | 二氯甲烷只有一种结构,可证明甲烷是正四面体构型 | |
| D. | 符合分子式为C4H10O能与金属钠反应的有机物有3种 |
10.下列物质含有共价键的是( )
| A. | KCl | B. | MgO | C. | H2O | D. | Na2O |
17.汽车铅蓄电池总反应:Pb+PbO2+2H3SO4═2PbSO4↓+2H3O,有关说法不正确的是( )
| A. | Pb 为负极,发生还原反应 | |
| B. | 放电过程,正负极质量均增重 | |
| C. | 导线中每通过 1mole-,溶液中减少 2molH+ | |
| D. | 电子由 Pb 经外电路流向 PbO3 |
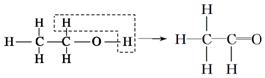
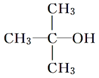

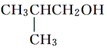
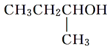
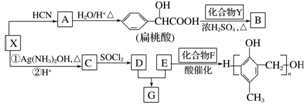
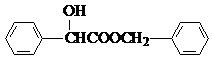 .
.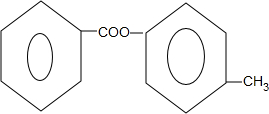 +2NaOH$\stackrel{△}{→}$
+2NaOH$\stackrel{△}{→}$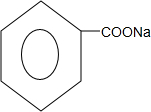 +
+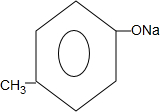 +H2O.
+H2O.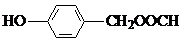 ,
,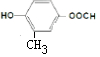 ,
, .
.